实验原理
原电池由正、负两个电极组成,电池在工作过程中,正极发生还原反应,负极发生氧化反应,电池反应是电池中所有反应的总和。电池的电动势等于两个电极的电极电势的差值:
![]() (1)
(1)
式中E+是正极的电极电势;E- 是负极的电极电势。
以ZnCu电池为例,其电池符号表示为
Zn|ZnSO4(![]() )||CuSO4(
)||CuSO4(![]() )|Cu
)|Cu
负极发生氧化反应: ![]()
正极发生还原反应: ![]()
电池的总反应为
![]()
根据能斯特(Nernst)方程,Zn电极的电极电势为:
![]() (2)
(2)
Cu电极的电极电势为:
![]() (3)
(3)
所以ZnCu电池的电动势为:
![]() (4)
(4)
纯固体的活度为1,即aCu=aZn=1,所以
![]() (5)
(5)
在一定温度下,电极电势的大小决定于电极的本性和溶液中有关离子的活度。标准电极电势可以在常用数据表中查到。
电池除可用作电源外,又可用来研究构成该电池的化学反应的热力学性质。从热力学可知,在恒温恒压可逆条件下,电池电动势E和电池反应的ΔG有如下关系:
ΔG=-zEF (6)
因此测定E,可求ΔG,进而求出其它热力学性质。以上公式必须在恒温恒压可逆条件下才能成立,这就要求电池反应本身是可逆的,即两个电极必须是可逆的。测量电池电动势时,必须使电池反应在热力学可逆条件下进行,即只限于有无限小的电流通过电池。另外,用电化学方法研究化学反应的热力学性质时,所设计的电池应尽量避免产生液体接界电位(在精确度不太高的测量中,常用“盐桥”来减少双液电池的液接电位)。为了使测量在接近热力学可逆条件下进行,应采用按补偿法原理设计的电位差计,而不能用伏特计来直接测量。因为当把伏特计与电池接通后,必然有适量的电流通过才能使伏特计有显示,这样电池中就会发生化学反应,溶液的浓度会不断改变。因而电动势也不断变化,这时的电池已不是可逆电池。另外,电池本身有内阻,用伏特计测量的只是两电极间的电势差,而不是可逆电池的电动势,只有在没有电流通过时的电势差才是电池的平衡电动势。
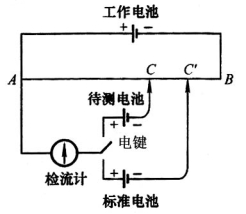
图9-1 对消法测电动势原理图
电位差计是利用对消法原理进行电动势测量的仪器,其基本原理如图9-1所示。AB为均匀滑线电阻,工作电池经AB构成一闭合回路,在闭合回路中流经一稳定电流强度I,在AB上产生均匀电势降。先将电键置向标准电池,使标准电池和检流计经ACC′构成一闭合回路,这样,就在标准电池的外电路中产生一个方向相反的电势差,它的大小由滑动接触点C′的位置决定,若在C′ 时检流计中无电流通过,则标准电池的电动势EN正好等于AC′段的电势差,即EN=IRAC′,RAC′为AC′段的电阻。同样再将电键置向待测电池,调节滑动接触点C使检流计中无电流通过,可得待测电池的电动势Ex=IRAC,则:
![]() (7)
(7)
因为AB为均匀导体,所以其电阻与长度成正比,即RAC/RAC′=![]() ,若已知EN,即可求得Ex。
,若已知EN,即可求得Ex。
应用对消法测量电动势具有以下优点:(1)完全对消时无电流通过电池;(2)不需要测定线路中的电流强度;(3)EX的测量精度完全依赖于EN和滑线电阻。
另外,当两种电极与不同电解质溶液接触时,在溶液的界面上总有液接电势存在,在电动势测量时,常用盐桥使原来产生显著液接电势的两种溶液彼此不直接接触并降低液接电势,常用KCl、NH4NO3等溶液作盐桥。