实验原理
物质在不同的温度、压力和组成下,可以处于不同的状态,其变化关系可以用几何图形表示出来,相图就是用几何方法表示系统相平衡状态的图形。二组分系统的相图可以分为二组分气-液系统和二组分固-液系统两大类,前者是“实验四”所研究的内容;后者属于凝聚系统,受压力的影响较小,其相图用温度-组成的平面图表示。
对二组分固-液合金系统,常用“热分析法”绘制系统的相图。所谓热分析法是对所研究的二组分系统,配成一系列不同组成的样品,加热使之完全熔化,然后再均匀降温,记录温度随时间的变化曲线——称之为“步冷曲线”。系统若有相变,必然产生相变热,使降温速率减慢,则在步冷曲线上会出现“拐点”或“平阶”,从而可以确定出相变温度。以横轴表示混合物的组成,纵轴表示温度,即可绘制出被测系统的相图,如图5-1所示。
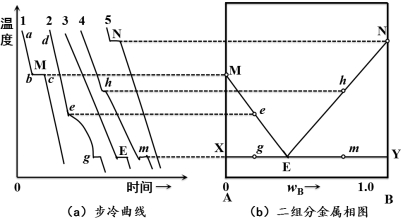
图 5-1 热分析法绘制相图
以A和B二组分系统为例,纯组分A的步冷曲线如图中“1”所示,高温液体从a点开始降温,从a到b的降温过程中没有发生相变,降温速率较快。当冷却到组分A的熔点时,固体A开始析出,系统处于固—液两相平衡,此时温度保持不变,故步冷曲线上出现bc段的平阶。当液体A全部凝固成固体A后,温度又继续下降。根据平阶所对应的温度,可以确定相图中的M点,即纯A的熔点。
混合物的步冷曲线与纯组分的步冷曲线有所不同,如图中步冷曲线“2”所示,从d到e是熔液单纯的降温过程,降温速率较快,当温度达到e点所对应的温度时,开始有固体A析出,系统呈两相平衡(熔液和固体A),但此时温度仍可下降,由于固体A析出时产生了相变热,故降温速率减慢,步冷曲线上出现了e点所对应的拐点,由此可以确定相图中的e点。随着固体A逐渐析出,熔液的组成不断改变,当温度达到g点时,又有固体B析出,此时系统处于三相平衡(熔液、固体A和固体B),根据相律可知,ƒ﹡=2-3+1=0,所以温度不变,步冷曲线上出现了平阶,根据此平阶温度,确定相图中的g点。当熔液全部凝固后,温度又继续下降,这是固体A和固体B的单纯降温过程。
步冷曲线“3”的特点是高温熔液在降温到E点所对应的温度以前没有任何固体析出。在达到E点所对应的温度时,固体A和固体B同时析出,此时系统呈三相平衡,由此确定了相图中的E点,E点以下是固体A和固体B的降温过程。
步冷曲线“4”与“2”类似,所不同的是在拐点h处析出的是固体B,在平阶m处又析出固体A,同样处于三相平衡,由此确定相图中的h点和m点。
步冷曲线“5”与“1”类似,其平阶N点对应纯组分B的熔点。
将各样品刚开始发生相变的各点M、e、E、h、N用线连接起来;g、E、m各点所对应的温度一样,用直线将它们连接起来;这样A-B二组分系统相图便绘制出来了。整个相图分为四个区域:MEN以上的区域为液相区L;MEX为固体A和液相两相共存区;ENY为固体B和液相两相共存区;XEY以下的区域为固体A和固体B的两相共存区。XEY线为三相线,处于该线上的系统是固体A、固体B与组成为E的熔液三相平衡共存;MeE线是固体A与熔液呈两相平衡时,熔液组成与温度关系的曲线,称为液相线;EhN线与MeE线相似,是固体B与熔液呈两相平衡时的液相线。E点称为简单低共熔点,该点对应的熔液所析出的混合物称为简单低共熔混合物。因此,此类相图被称为简单低共熔系统相图。
本实验是利用“热分析法”测定一系列不同组成的Pb-Sn混合物的步冷曲线,从而绘制出此二组分系统的金属相图。利用程序升降温仪控制电炉的加热和降温,可以人为设定降温速率,通过热电偶采集温度数据使步冷曲线直接显示在微机屏幕上,同时在程序升降温控制仪上配有温度数值显示和定时报鸣时间,因此也可手工记录画出步冷曲线。