知识点一
一. 实验目的
1. 学习混合碱的组成及其含量的测定方法;
2. 掌握“双指示剂法”的原理和方法。
二. 实验原理
混合碱是Na2CO3与NaOH或NaHCO3与Na2CO3的混合物。可采用HC1标准溶液作为滴定剂,根据滴定过程中体系出的变化情况,选用两种不同的指示剂,分别指示第一、第二滴定终点的到达,根据两种指示剂变色时所消耗的HC1标准溶液的体积,判断混合碱的组成,并计算出混合碱中各组分的含量,这种方法称为“双指示剂法”。
以HC1标准溶液滴定混合碱试液(Na2CO3和NaOH)时,先加入酚酞指示剂,当到达第一滴定终点时,指示剂由红色刚好褪为无色,溶液的pH约为8.3,试液中所含NaOH完全被滴定,而Na2CO3则被中和一半,转化为NaHCO3。此阶段消耗的滴定剂HC1的体积为V1(mL)。反应式为
NaOH+HC1=NaCl+H20
Na2CO3+HCl=NaHCO3+NaCl
再加入甲基橙指示剂,继续用HC1标准溶液滴定,当到达第二滴定终点时,指示剂由黄色刚好变为橙色,溶液的pH约为4.0,NaHCO3被中和成H2CO3,此阶段消耗的滴定剂HCI的体积为V2(mL)。反应式为
NaHCO3+HCI=NaCl+H2O+CO2↑
设混合碱试液的体积为V(mL),可根据V1和V2计算出混合碱试液中两种碱的含量。
当V1>V2时,混合碱试液为Na2CO3和NaOH的混合物。各组分的含量以质量浓度ρ/(g·L-1)表示,由式(l)、式(2)计算:
(1)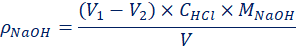
(2)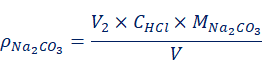
当V1 (3) (4) 当V1=V2时,样品组成为Na2CO3;当V1=0,V2≠0时,样品组成为NaHCO3;当V1≠0,V2=0时,样品组成为NaOH。
混合碱的总碱度,通常以Na2O的含量来表示,计算公式如下:
1.仪器: 电子天平、酸式滴定管(50 mL)、移液管(25 mL)、容量瓶(250 mL)、锥形瓶、试剂瓶、烧杯、量筒、铁架台、蝴蝶夹、洗耳球、称量纸。
2.药品:浓盐酸、无水Na2CO3基准物质、甲基橙(0.2 %水溶液)、酚酞(0.2 %乙醇溶液)、混合碱试液。
1. 电子天平的使用和注意事项
电子天平种类繁多,但其使用方法大同小异,具体操作可参阅各电子天平的使用说明书。一般使用方法如下:
1)使用前,先进行水平调节。查看水平仪是否水平,如不水平,应调整水平调节脚,将水平仪中的气泡调至水平仪中央。
2)接通电源,预热至规定时间后,开启显示器。天平在初次接通电源或长时间断电后,至少需要预热30min,才可开启显示器。
3)轻按ON/OFF键,开启显示器,天平进行系统自检,约2 s后,自检结束,显示称量模式0.0000 g。如果天平显示不是0.0000 g,则需按一下TARE键。
4)将称量物轻放在称盘上,关上天平门,待显示器上数字稳定,并出现质量单位g后,即可读数,记录称量结果。
5) 若需清零、去皮重,轻按TARE键。置容器于称盘上,显示器上显示出容器的质量,轻按TARE键,随即出现全零状态0.0000 g,容器质量显示值已去除,即去皮重。当取出容器后,显示器上则显示出容器质量的负值。
6) 称量完毕,取下被称物,关好天平门,轻按ON/OFF键,天平处于待机状态。实验全部结束后,应拔下电源插头,盖上防尘罩。
注意:因长时间存放、位置移动、环境变化,或为获得精确称量,电子天平在第一次使用前或在使用一段时间后都应进行校准操作(参见各电子天平说明书)。
电子天平使用注意事项
1) 应放置在平坦的台面上,避免震动、阳光直射及气流的影响。
2) 应远离热源和高强电磁场等环境。
3) 称量物不得超过天平的最大载重量,以免损坏天平。
4) 化学试剂不能直接放在天平称盘上,应在称量纸或洁净的器皿中称量。
5)不能在天平上称量过热或过冷的物体。易挥发、易吸潮和具有腐蚀性的试剂必须放在密闭容器中称量,以免腐蚀或损坏天平。
6)保持天平清洁干净。当天平称盘上有散落样品时,应及时关闭电源,仔细地用毛刷清理天平。
7)如果发现天平不正常,应及时报告教师,不要自行处理。
8)天平使用一段时间(半年或一年)后,实验技术人员应检查天平的计量性能,并调整天平的灵敏度。
称量方法
常用称量方法有:直接称量法、递减称量法(差减法)、固定质量称量法(增量法)。本次实验采用递减称量法(差减法)。
递减称量法用于称量一定质量范围的样品。此法适用于一般的粒状、粉末状固体及易吸潮样品等。当用基准物质配制标准溶液时,基准物质的称量一般采用此种方法。递减称量法使用的称量器皿是称量瓶。称量瓶用前要洗净烘干,称量时不能用手直接拿取称量瓶,应用纸条套住瓶身中部,再用手捏紧纸条,开关瓶盖时,应用纸片夹住称量瓶盖柄,以防手上的汗污等影响称量的准确度。
具体称样方法:将盛有样品的称量瓶放在天平称盘上,准确称量出样品加称量瓶的质量m1。将称量瓶从天平上取出,在盛接样品的容器上方倾斜瓶身,用称量瓶盖轻敲瓶口上部,使样品慢慢落入容器中,当倾出的样品接近所需质量时,一边继续用瓶盖轻敲瓶口上部,一边慢慢地将称量瓶竖起,使粘在瓶口的样品落回称量瓶中,然后盖好瓶盖(上述操作均应在容器上方进行,防止样品丢失),将称量瓶再放到天平称盘上,准确称其质量m2。两次质量之差m1-m2,即为样品的质量。如此继续进行,可称取多份样品。如果一次倾出的样品不足所需用的质量范围时,可按上述操作继续倾出。如果超出所需的质量范围,不准将已倾出的样品再倒回称量瓶中,此次称量作废,应重新进行称量。
2. 标准溶液的配制和标定
1) 滴定分析相关概念
① 标准溶液:标准溶液是指已知准确浓度的溶液或已知其特性量值的溶液。溶液的浓度应表示为物质的量浓度(单位为mol·m-3或mol·L-1)。在常量分析中一般要求有4位有效数字。
② 标准物质:在滴定分析中,不是什么试剂都可以用来直接配制标准溶液,能用于直接配制标准溶液或直接标定标准溶液浓度的物质,称为基准物质或标准物质。
2)基准物质应具备的条件:
① 试剂的组成与其化学式完全相符;
② 试剂的纯度应足够高(一般要求在99.9%以上),而杂质的含量应少到不致于影响分析的准确度;
③试剂在一般条件下应该稳定;
④ 试剂参加反应时,应按反应式定量进行,没有副反应;
⑤ 试剂的摩尔质量尽可能大。
3)标准溶液的配制方法:直接法和标定法(或间接法)。
① 直接法:用基准物质直接配制。用分析天平(万分之一)准确称取一定量基准物质,溶于适量的水中,再定量转移到容量瓶中,用水稀释到刻度。根据所称量基准物质的质量和溶液的体积,即可计算出该标准溶液的准确浓度。
② 标定法:也称间接法,是最普遍的配制标准溶液的方法。由于符合基准物质条件的试剂有限,很多试剂不能直接配制成标准溶液,可采用标定法配制其标准溶液,即先将其配成一种接近所需浓度的溶液,然后用适当的基准物质(或已经用基准物质标定过的标准溶液)来标定其准确浓度。
3. 滴定分析
1)滴定分析法:将已知准确浓度的试剂溶液(标准溶液)滴加到被测的试样溶液中,直到所加的试剂与被测物质定量反应完全时为止,然后根据标准溶液的浓度、体积及化学计量关系求得被测物质含量的分析方法。
2)滴定:滴定分析中,通常将被测物质的溶液置于锥形瓶中,再把标准溶液通过滴定管逐滴加到锥形瓶里,这样的操作过程叫“滴定”。
3)化学计量点:滴入的标准溶液与被测物质正好按二者的化学反应计量关系定量反应完全时,称反应到达化学计量点。由于许多反应在计量点时无外观变化,计量点一般依据指示剂的变色来确定
4)滴定终点:滴定进行至指示剂正好发生颜色转变时为止。
5)终点误差:滴定终点与化学计量点不一定一致,由此造成的分析误差。
6)滴定突跃范围:计量点前后+/-0.1%相对误差范围内溶液pH值的变化范围。
7)选择指示剂的依据:为使终点误差小于+/-0.1%,指示剂的变色范围应全部或部分落在滴定突跃范围内。通常选择在滴定突跃范围内变色的指示剂。
8)甲基橙(简写MO)的pH变色域为3.1(红)~4.4(黄),酸色型为红色,碱色型为黄色,pH=4.0时为橙色。两种色型均有颜色,称为双色指示剂。用NaOH滴定HCI,指示剂的颜色变化是红一橙一黄;用HCl滴定NaOH,指示剂的颜色变化是黄一橙一红。终点时,要通过控制半滴(0.02 mL)酸或碱,准确判断橙色。对于强酸强碱的滴定体系,用碱滴酸或用酸滴碱,均可以选用甲基橙作指示剂。
9)酚酞(简写PP)的pH变色域为8.0(无)~10.0(红),pH=9.0时为浅粉红色。因为只有碱色型有颜色,称为单色指示剂,常用酚酞指示滴定终点时为碱性范围的滴定体系,指示剂由无色变为浅粉色,若半分钟不退即为终点。
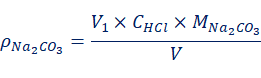
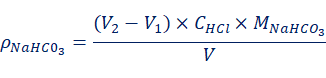
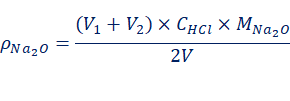
三. 仪器与材料
四.实验预习
