知识点二:实验内容、数据处理、问题讨论
实验内容是同学们验证猜想,得出结论所需的必要过程;数据处理是对原理公式进行运用;问题讨论是对整个实验的总结和注意事项的思考。
一. 实验内容
1. 0.1 mol·L-1HCl标准溶液的配制和标定
1) 配制:用量筒量取4.2mL浓盐酸倒人试剂瓶中,用蒸馏水稀释至500ml,盖上玻璃塞,摇匀。
2) 标定:准确称取0.10~0.12 g(准确至0.0001 g)无水Na2CO3三份,分别置于250 mL锥形瓶中,加20~30mL蒸馏水溶解后,加入1~2滴甲基橙指示剂,用待标定的HCI溶液滴至溶液由黄色变为橙色,记录所消耗HCI溶液的体积,计算HCl标准溶液的浓度(保留四位有效数字)。
2. 混合碱的测定
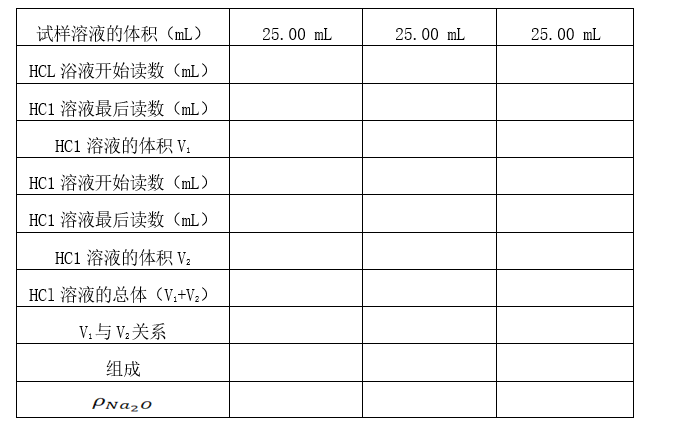
1) 准确移取25.00 mL混合碱试液于锥形瓶中,加入2~3滴酚酞指示剂,用HCl标准溶液滴至溶液由红色刚好变为无色为止,记录所消耗HCl标准溶液的体积V1,再加入1-2滴甲基橙指示剂,继续滴至溶液由黄色刚好变为橙色为止,记录第二次消耗HCI标准溶液的体积V2,平行测定3次。
2) 根据所消耗的HCl标准溶液V1与V2的体积和浓度,来判断混合碱的组成,并计算各组分的含量和混合碱的总碱度。分别计算各测定结果的精密度,其中总碱度测定的相对平均偏差不大于0.3 %。
注意事项
双指示剂法虽然操作简便,但因在第一计量点时酚酞变色不明显(红→微红),误差在1 %左右。若要求提高测定的准确度,可改用氯化钡法。
1)混合碱系NaOH和Na2CO3组成时,酚酞指示剂可适当多加几滴,否则常因滴定不完全使NaOH的测定结果偏低,Na2CO3的测定结果偏高。
2)最好用NaHCO3。的酚酞溶液(浓度相当)作对照。在达到第一终点前,不要因为滴定速度过快,造成溶液中HCl局部过浓,引起CO2的损失,带来较大的误差,滴定速度也不能太慢,摇动要均匀。
3)近终点时,一定要充分摇动,以防形成CO2的过饱和溶液而使终点提前到达。
二. 数据处理
实验结果记录在表1中
表1. 实验结果
三. 问题讨论
1. 溶解基准物质时加入20~30 mL水,是用量筒量取,还是用移液管移取?为什么?
答:因为这时所加的水只是溶解基准物质,而不会影响基准物质的量。因此加入的水不需要非常准确。所以可以用量筒量取。
2. 标准溶液装入滴定管之前,为什么要用该溶液润洗滴定管2~3次?而锥形瓶是否也需用该溶液润洗或烘干,为什么?
答:为了避免装入后的标准溶液被稀释,所以应用该标准溶液润洗滴管2~3次。而锥形瓶中有水也不会影响被测物质量的变化,所以锥形瓶不需先用标准溶液润洗或烘干。
3. 在第一个滴定终点前HCL要一滴一滴的加入,而且要在剧烈摇动下进行,为什么?
答:一滴一滴加入是为了防止太快达到终点而没有控制好速度导致加入的HCl过量,剧烈摇晃是为了使指示剂与溶液混合均匀,避免30秒后颜色变回去。
