◆本章概览
一、学习目标
 1、 学习KMnO4溶液的配制方法及保存条件;
1、 学习KMnO4溶液的配制方法及保存条件;
 2、掌握用Na2C2O4标定KMnO4标准溶液的原理和条件;
2、掌握用Na2C2O4标定KMnO4标准溶液的原理和条件;
 3、掌握高锰酸钾法测定H2O2含量的原理和方法。
3、掌握高锰酸钾法测定H2O2含量的原理和方法。
二、本章要求掌握的重点:
 1、掌握基准物质的选择,学习分析天平的使用并掌握递减称量法;
1、掌握基准物质的选择,学习分析天平的使用并掌握递减称量法;
 2、学习标准溶液的配制和标定方法。
2、学习标准溶液的配制和标定方法。
三、实验原理
双氧水含量的测定
双氧水(H2O2)在工业、生物、医学等方面应用广泛。利用H2O2的氧化性漂白毛和丝织物,纯的H2O2用作火箭燃料的氧化剂,工业上利用H2O2的还原性除去氯气,医学上常用H2O2进行消毒和杀菌,双氧水是医学上最常使用的消毒液。H2O2分子中有过氧链(-O-O-),氧的氧化数为-1,既有强氧化性又有还原性。在强酸性条件下,可用KMnO4标准溶液直接测定H2O2含量,其反应如下:
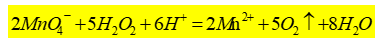
此反应在室温下进行。滴定开始时,反应速率慢,随着Mn2+的产生,反应速率会逐渐加快。也可向该反应中加入2-3滴MnSO4溶液作为催化剂,以加快反应速率。本实验应用高锰酸钾法测定医用消毒液中H2O2的含量(单位:g·L-1)。
四、基本操作
1.正确使用滴定管
滴定管是容量分析中最基本的测量仪器,它是由具有准确刻度的细长玻璃管及滴定管是容量分析中最基本的测量仪器,是在滴定时用来测定自管内流出溶液的体积。
1)滴定管的种类
① 酸式滴定管(玻塞滴定管)
② 碱式滴定管
2)使用前的准备
① 无明显油污的滴定管,直接用自来水冲洗或用肥皂水或洗衣粉水泡洗,但不能用去污粉洗以免划伤内壁,影响体积的准确测量。
② 有油污不易洗净时,用铬酸洗液洗涤。
③ 油污严重时,需用较多洗液浸泡更长时间,洗净的滴定管其内壁不挂水珠。
3)酸式滴定管的涂油
4)试漏。
5) 滴定管的装标准溶液和赶气泡
6)进行滴定操作时,应将滴定管夹在滴定管架上。
7)滴定管使用完后,应洗净打开旋塞倒置于滴定管架上。
8)碱式滴定管的使用方法
① 试漏。
② 滴定管内装入标准溶液后,要将尖嘴内的气泡排出。
③ 进行滴定操作时,用左手的拇指和食指捏住玻璃珠中部靠上部位的橡皮管外侧,向手心方向捏挤橡皮管,使其与玻璃珠之间形成一条缝隙,溶液即可流出。其他操作同酸式滴定管。
9)滴定管操作注意事项
① 滴定管在装满标准溶液后,管外壁的溶液要擦干,以免流下或溶液挥发而使管内溶液降温(在夏季影响尤大)。手持滴定管时,也要避免手心紧握装有溶液部分的管壁,以免手温高于室温(尤其在冬季)而使溶液的体积膨胀,造成读数误差。
② 使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作。在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出。
③ 每次滴定须从刻度零开始,以使每次测定结果能抵消滴定管的刻度误差。
④ 在装满标准溶液后,滴定前“初读”零点,应静置 1~2 分钟再读一次,如液面读数无改变,仍为零,才能滴定。滴定时不应太快,每秒钟放出 3~4 滴为宜,更不应成液柱流下,尤其在接近计量点时,更应一滴一滴逐滴加入(在计量点前可适当加快些滴定)。滴定至终 点后,须等 1~2 分钟,使附着在内壁的标准溶液流下来以后再读数,如果放出滴定液速度相当慢时,等半分钟后读数亦可,“终读 ”也至少读两次。
⑤ 滴定管读数可垂直夹在滴定管架上或手持滴定管上端使自由地垂直读取刻度,读数时还应该注意眼睛的位置与液面处在同一水平面上,否则将会引起误差。读数应该在弯月面下缘最低点,但遇标准溶液颜色太深,不能观察下缘时,可以读液面两侧最高点,“初读”与“终读”应用同一标准。
⑥ 滴定管有无色、棕色两种,一般需避光的滴定液(如硝酸银标准溶液、硫代硫酸钠标准溶液等),需用棕色滴定管。
2. 正确使用容量瓶
1)查漏。
2)洗涤。
3)配制溶液。
4)配制一定体积的溶液,须选用与该溶液体积相同规格的容量瓶。
5)定容。
6)混匀。
7)容量瓶通常不用于贮存试剂,因此,配制好的溶液要倒入试剂瓶中,并贴上标签。
五.实验内容
1. 0.02 mol·L-1KMn04溶液的配制和标定
(1)配制:用最简量取20 mL 0.2 mol·L-1 KMnO4溶液倒入试剂瓶中,用蒸馏水稀释至200 mL,盖上玻璃塞,摇匀。
(2)标定:准确称取0.13-0.17 g (准确至0.0001 g) Na2C2O4三份,分别置于250 mL锥形瓶中,加入40-50 mL蒸馏水溶解,再加入10 mL3 mol·L-1 H2SO4溶液,加热至75-85℃,趁热用待标定的KMnO4溶液滴至溶液出现微红色,30 s内不褪即为终点,记录所消耗KMnO4标准溶液的体积,计算KMnO4标准溶液的浓度(保留四位有效数字)。
2. 医用消毒液中H2O2含量的测定
用吸量管准确移取10.00 mL医用消毒液于250 mL容量瓶中,加蒸馏水稀释至刻度,摇匀。用移液管准确移取25.00 mL上述溶液于锥形瓶中,加5 mL 3 mol·L-1 H2SO4溶液,用KMnO4标准溶液滴至溶液出现微红色,30 s内不褪即为终点,记录所消耗KMnO4标准溶液的体积。平行滴定2-3次。计算医用消毒液中H2O2的含量 (g·L-1)
六.问题讨论
1. 在KMnO4法中如果H2SO4用量不足,对结果有何影响?
2. 用KMnO4法测定H2O2时,能否用HNO3或HCl来控制酸度?
3.KMnO4标准溶液为什么不能直接配制?
4.为什么KMnO4溶液放置1周后才能标定?
5.KMnO4法测H2O2含量时,其滴定速度为何不能太快?
6.如果双氧水样品不稀释,直接测定H2O2含量,其结果如何?
◆小牛试刀
问题一:高锰酸钾法常用什么作指示剂?如何指示终点?
答:高锰酸钾法的指示剂是KMnO4本身,在100 mL 水中只要加1滴0.1 mol·L-1 KMnO4溶液就可以呈现明显的紫红色。而它的还原产物Mn2+则近无色。因此滴定至粉红色即为终点。
问题二:2. 用KMnO4法测定H2O2时,能否用HNO3或HCl来控制酸度?
答:不能。
(1)酸性高锰酸钾溶液会氧化盐酸,所以不能用盐酸酸化。
2MnO4- +10Cl-+16H+=2Mn2++5Cl2↑+8H2o
(2)HNO3具有强氧化性,会干扰KMnO4与H2O2的正常反应。

