知识点一:实验目的、原理、仪器与器材、实验预习
所谓实验目的是对某猜想或方法的验证和各种假设、设想、理论的正确性,可行性,以及找出、改良各种各样达到目的的途径;实验原理是指导整个实验的理论基础;熟悉仪器与器材为今后其他实验打下基础;进行实验预习了解该实验的基本操作,为接下来同学们自己动手操做奠定基础。
一、实验目的
1.学习KMnO4溶液的配制方法及保存条件;
2.掌握用Na2C2O4标定KMnO4标准溶液的原理和条件;
3.掌握高锰酸钾法测定H2O2含量的原理和方法。
二、实验原理
利用KMnO4在强酸性溶液中的强氧化性,以KMnO4标准溶液作滴定剂测定样品中被测物质含量的方法,称为KMnO4法。
1.KMnO4溶液的配制及标定
由于KMnO4固体试剂中常含有少量MnO2和其他杂质,而且蒸馏水中也常含有微量的还原性物质,能与KMnO4作用析出MnO(OH)2沉淀,MnO2和MnO(OH)2又进一步促进KMnO4的分解。因此,KMnO4标准溶液用标定法配制。配制KMnO4溶液时,通常称取稍多于理论量的KMnO4固体,溶解在规定体积的蒸馏水中,盖上表面皿,加热煮沸(微佛)1h,放置2-3d后,使各种还原性物质完全氧化,用微孔玻璃砂芯漏斗过滤,除去沉淀。将过滤后的KMnO4溶液储存于棕色瓶中,放置暗处,以待标定。标定KMnO4的基准物质有H2C2O4·2H2O,Na2C2O4,(NH4)2Fe(SO4)2·6H2O,纯铁丝等,其中以Na2C2O4最为常用。
在H2SO4溶液中,MnO4-与C2O42-的反应:
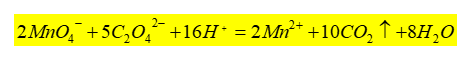
为了使上述反应能快速定量地进行,应注意以下条件:
1)温度:反应适宜的温度为75-85 ℃。在室温下,该反应速率缓慢,需将溶液加热。加热温度也不能过高(温度高于90 ℃),会引起H2C2O4分解:
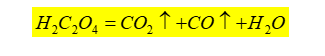
2)酸度:为了使滴定反应能够正常进行,溶液应保持足够的酸度。一般在开始滴定时溶液的酸度为0.5-0.6 mol·L-1,滴定终点时溶液的酸度为0.3 mol·L-1。酸度过低时,往往容易生成MnO2,酸度过高时,促使H2C2O4分解。
3)滴定速度:该反应是一个自动催化反应,随着Mn2+ 的产生,反应速率逐渐加快。开始滴定时,应逐滴缓慢加入KMnO4 溶液,在第1滴KMnO4 红色没有褪去之前,不急于加入第2滴。待溶液中生成具有催化作用的Mn2+ 后,反应速率加快。但在滴定过程中,仍需逐滴加入KMnO4溶液,如果滴加速度过快,部分KMnO4溶液来不及与C2O42- 反应,就会在热的溶液中按下式分解,导致标定结果偏低。
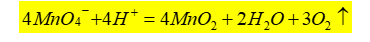
4)滴定终点:滴定终点溶液呈现的微红色不能持久,是因为空气中的还原性物质和灰尘都能与KMnO4缓慢作用,使之还原为Mn2+,使溶液的微红色消失。
5)指示剂:MnO4- 本身具有鲜明的紫红色,在滴定无色或浅色溶液时,可利用MnO4- 自身的颜色指示终点,为自身指示剂。
2.双氧水含量的测定
双氧水(H2O2)在工业、生物、医学等方面应用广泛。利用H2O2的氧化性漂白毛和丝织物,纯的H2O2用作火箭燃料的氧化剂,工业上利用H2O2的还原性除去氯气,医学上常用H2O2进行消毒和杀菌,双氧水是医学上最常使用的消毒液。H2O2分子中有过氧链(-O-O-),氧的氧化数为-1,既有强氧化性又有还原性。在强酸性条件下,可用KMnO4标准溶液直接测定H2O2含量,其反应如下:
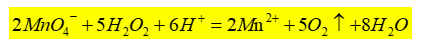
此反应在室温下进行。滴定开始时,反应速率慢,随着Mn2+ 的产生,反应速率会逐渐加快。也可向该反应中加入2-3滴MnSO4溶液作为催化剂,以加快反应速率。本实验应用高锰酸钾法测定医用消毒液中H2O2的含量(单位:g·L-1)。
三、仪器与器材
1)仪器: 电子天平、酸式滴定管(50 mL)、移液管(25 mL)、吸量管(10 mL)、容量瓶(250 mL)、锥形瓶、试剂瓶、称量瓶、烧杯、量筒、电热套、铁架台、蝴蝶夹、洗耳球、称量纸。
2)药品:KMn04溶液(0.2 mol·L-1)、Na2C2O4基准物质、H2SO4溶液(3 mol·L-1)、医用消毒液(H2O2约3%)。
四、实验预习
1.正确使用滴定管
滴定管是容量分析中最基本的测量仪器,它是由具有准确刻度的细长玻璃管及滴定管是容量分析中最基本的测量仪器,是在滴定时用来测定自管内流出溶液的体积。
1)滴定管的种类
① 酸式滴定管(玻塞滴定管)
② 碱式滴定管
2)使用前的准备
① 无明显油污的滴定管,直接用自来水冲洗或用肥皂水或洗衣粉水泡洗,但不能用去污粉 洗以免划伤内壁,影响体积的准确测量。
② 有油污不易洗净时,用铬酸洗液洗涤。
③ 油污严重时,需用较多洗液浸泡更长时间,洗净的滴定管其内壁不挂水珠。
3)酸式滴定管的涂油
4)试漏。
5) 滴定管的装标准溶液和赶气泡
6)进行滴定操作时,应将滴定管夹在滴定管架上。
7) 滴定管使用完后,应洗净打开旋塞倒置于滴定管架上。
8)碱式滴定管的使用方法
① 试漏。给碱式滴定管装满水后夹在滴定管架上静置5分钟。若有漏水应更换橡皮管或管内玻璃珠,直至不漏水且能灵活控制液滴为止。
② 滴定管内装入标准溶液后,要将尖嘴内的气泡排出。方法是:把橡皮管向上弯曲,出口上斜,挤捏玻璃珠,使溶液从尖嘴快速喷出,气泡即可随之排掉。
③ 进行滴定操作时,用左手的拇指和食指捏住玻璃珠中部靠上部位的橡皮管外侧,向手心方向捏挤橡皮管,使其与玻璃珠之间形成一条缝隙,溶液即可流出。其他操作同酸式滴定管。
9)滴定管操作注意事项
① 滴定管在装满标准溶液后,管外壁的溶液要擦干,以免流下或溶液挥发而使管内溶液降温(在夏季影响尤大)。手持滴定管时,也要避免手心紧握装有溶液部分的管壁,以免手温高于室温(尤其在冬季)而使溶液的体积膨胀,造成读数误差。
② 使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作。在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出。
③ 每次滴定须从刻度零开始,以使每次测定结果能抵消滴定管的刻度误差。
④ 在装满标准溶液后,滴定前“初读”零点,应静置 1~2 分钟再读一次,如液面读数无改变,仍为零,才能滴定。滴定时不应太快,每秒钟放出 3~4 滴为宜,更不应成液柱流下,尤其在接近计量点时,更应一滴一滴逐滴加入(在计量点前可适当加快些滴定)。 滴定至终点后,须等 1~2 分钟,使附着在内壁的标准溶液流下来以后再读数,如果放出滴定液速度相当慢时,等半分钟后读数亦可,“终读”也至少读两次。
⑤ 滴定管读数可垂直夹在滴定管架上或手持滴定管上端使自由地垂直读取刻度,读数时还应该注意眼睛的位置与液面处在同一水平面上,否则将会引起误差。读数应该在弯月面下缘最低点,但遇标准溶液颜色太深,不能观察下缘时,可以读液面两侧最高点,“初读”与“终读”应用同一标准。
⑥ 滴定管有无色、棕色两种,一般需避光的滴定液(如硝酸银标准溶液、硫代硫酸钠标准 溶液等),需用棕色滴定管。2.正确使用容量瓶
容量瓶,是一种细颈梨形平底的玻璃容器,带有磨口玻璃塞,颈上有标线。表示在所指温度下液体凹液面与容量瓶颈部的标线相切时,溶液体积恰好与瓶上标注的体积相等。容量瓶上标有:温度、容量、 刻度线。它主要用于直接法配制标准溶液和准确稀释溶液以及制备样品溶液。容量瓶也叫量瓶,它的使用方法如下:
(1)查漏。使用前要检验是否漏水,程序是:加水至标线附近,盖好塞,用右手拿住瓶颈上端,食指压住瓶塞,左手指托住瓶底,将容量瓶倒置2分钟,观察是否漏水,如不漏水,将瓶塞旋转180°,再检查一次,如不漏才可使用;
(2)洗涤。用少量铬酸洗液润洗至内壁不挂水珠,再依次用自来水和蒸馏水洗净;
(3)配制溶液。容量瓶不能用于溶解溶质,更不能用玻璃棒搅拌。因此要先把准确称量好的固体溶质放在干净的烧杯中,用少量溶剂溶解 (如果放热,要放置使其降温到室温)。然后把溶液转移到容量瓶里,转移时要用玻璃棒引流。方法是玻璃棒一端靠在容量瓶颈内壁上,注意不要让玻璃棒其它部位触及容量瓶口,防止液体流到容量瓶外壁上。转移液体器皿需要在转移后洗涤三次,不能将热的溶液转移到容量瓶中,更不能给容量瓶加热。如果溶质在溶解时是放热的,则须待溶液冷却后再移液。
(4)配制一定体积的溶液,须选用与该溶液体积相同规格的容量瓶。常用的有50 mL、100 mL、250 mL、500 mL、1000 mL等规格。
(5)定容。当溶液达容量瓶的2/3时,可将容量瓶沿水平方向摇晃几周使溶液初步混合均匀(此时绝不能倒转容量瓶)再加溶剂至标线以下约1 cm,等待1-2分钟,然后滴加溶剂至刻线,盖紧瓶塞。一定要平视,使液面的最低点刚好与刻度线相平。
(6)混匀。用右手拿住瓶颈上端,食指压住瓶塞,左手指托住瓶底,将容量瓶倒置15次以上,且摇动几周,反复操作可使溶液充分混匀;
(7)容量瓶通常不用于贮存试剂,因此,配制好的溶液要倒入试剂瓶中,并贴上标签。
