知识点一:实验目的、原理、仪器与器材、实验预习
第二部分:实验原理
教师讲解
利用KMnO4在强酸性溶液中的强氧化性,以KMnO4标准溶液作滴定剂测定样品中被测物质含量的方法,称为KMnO4法。
1.KMnO4溶液的配制及标定
由于KMnO4固体试剂中常含有少量MnO2和其他杂质,而且蒸馏水中也常含有微量的还原性物质,能与KMnO4作用析出MnO(OH)2沉淀,MnO2和MnO(OH)2又进一步促进KMnO4的分解。因此,KMnO4标准溶液用标定法配制。配制KMnO4溶液时,通常称取稍多于理论量的KMnO4固体,溶解在规定体积的蒸馏水中,盖上表面皿,加热煮沸(微佛)1h,放置2-3d后,使各种还原性物质完全氧化,用微孔玻璃砂芯漏斗过滤,除去沉淀。将过滤后的KMnO4溶液储存于棕色瓶中,放置暗处,以待标定。标定KMnO4的基准物质有H2C2O4·2H2O,Na2C2O4,(NH4)2Fe(SO4)2·6H2O,纯铁丝等,其中以Na2C2O4最为常用。
在H2SO4溶液中,MnO4-与C2O42-的反应:
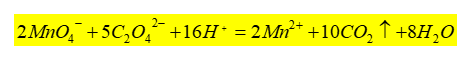
为了使上述反应能快速定量地进行,应注意以下条件:
1)温度:反应适宜的温度为75-85 ℃。在室温下,该反应速率缓慢,需将溶液加热。加热温度也不能过高(温度高于90 ℃),会引起H2C2O4分解:
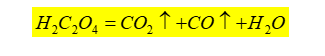
2)酸度:为了使滴定反应能够正常进行,溶液应保持足够的酸度。一般在开始滴定时溶液的酸度为0.5-0.6 mol·L-1,滴定终点时溶液的酸度为0.3 mol·L-1。酸度过低时,往往容易生成MnO2,酸度过高时,促使H2C2O4分解。
3)滴定速度:该反应是一个自动催化反应,随着Mn2+ 的产生,反应速率逐渐加快。开始滴定时,应逐滴缓慢加入KMnO4 溶液,在第1滴KMnO4 红色没有褪去之前,不急于加入第2滴。待溶液中生成具有催化作用的Mn2+ 后,反应速率加快。但在滴定过程中,仍需逐滴加入KMnO4溶液,如果滴加速度过快,部分KMnO4溶液来不及与C2O42- 反应,就会在热的溶液中按下式分解,导致标定结果偏低。
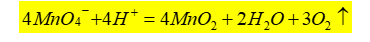
4)滴定终点:滴定终点溶液呈现的微红色不能持久,是因为空气中的还原性物质和灰尘都能与KMnO4缓慢作用,使之还原为Mn2+,使溶液的微红色消失。
5)指示剂:MnO4- 本身具有鲜明的紫红色,在滴定无色或浅色溶液时,可利用MnO4- 自身的颜色指示终点,为自身指示剂。
2.双氧水含量的测定
双氧水(H2O2)在工业、生物、医学等方面应用广泛。利用H2O2的氧化性漂白毛和丝织物,纯的H2O2用作火箭燃料的氧化剂,工业上利用H2O2的还原性除去氯气,医学上常用H2O2进行消毒和杀菌,双氧水是医学上最常使用的消毒液。H2O2分子中有过氧链(-O-O-),氧的氧化数为-1,既有强氧化性又有还原性。在强酸性条件下,可用KMnO4标准溶液直接测定H2O2含量,其反应如下:
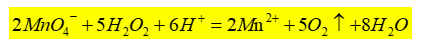
此反应在室温下进行。滴定开始时,反应速率慢,随着Mn2+ 的产生,反应速率会逐渐加快。也可向该反应中加入2-3滴MnSO4溶液作为催化剂,以加快反应速率。本实验应用高锰酸钾法测定医用消毒液中H2O2的含量(单位:g·L-1)。
边学边练
在用KMnO4法测定H2O2含量时,为加快反应可加入( )。
A.H2SO4 B.MnSO4 C.KMnO4 D.NaOH
教师解析:答案为B,MnSO4溶液是催化剂,能加快反应,现象更明显。
