知识点一:混合碱的测定
第二部分:实验原理
混合碱是Na2CO3与NaOH或NaHCO3与Na2CO3的混合物。可采用HC1标准溶液作为滴定剂,根据滴定过程中体系出的变化情况,选用两种不同的指示剂,分别指示第一、第二滴定终点的到达,根据两种指示剂变色时所消耗的HC1标准溶液的体积,判断混合碱的组成,并计算出混合碱中各组分的含量,这种方法称为“双指示剂法”。
以HC1标准溶液滴定混合碱试液(Na2CO3和NaOH)时,先加入酚酞指示剂,当到达第一滴定终点时,指示剂由红色刚好褪为无色,溶液的pH约为8.3,试液中所含NaOH完全被滴定,而Na2CO3则被中和一半,转化为NaHCO3。此阶段消耗的滴定剂HC1的体积为V1(mL)。反应式为
NaOH+HC1=NaCl+H20
Na2CO3+HCl=NaHCO3+NaCl
再加入甲基橙指示剂,继续用HC1标准溶液滴定,当到达第二滴定终点时,指示剂由黄色刚好变为橙色,溶液的pH约为4.0,NaHCO3被中和成H2CO3,此阶段消耗的滴定剂HCI的体积为V2(mL)。反应式为
NaHCO3+HCI=NaCl+H2O+CO2↑
设混合碱试液的体积为V(mL),可根据V1和V2计算出混合碱试液中两种碱的含量。
当V1>V2时,混合碱试液为Na2CO3和NaOH的混合物。各组分的含量以质量浓度ρ/(g·L-1)表示,由式(l)、式(2)计算:
(1)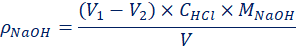
(2)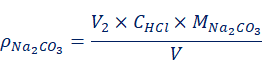
当V1< V2时,混合碱试液为NaHCO3与Na2CO3的混合物。各组分的含量由式(3)、式(4)计算:
(3)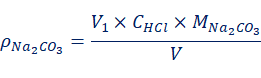
(4)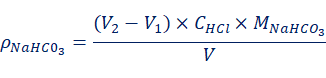
当V1=V2时,样品组成为Na2CO3;当V1=0,V2≠0时,样品组成为NaHCO3;当V1≠0,V2=0时,样品组成为NaOH。
混合碱的总碱度,通常以Na2O的含量来表示,计算公式如下:
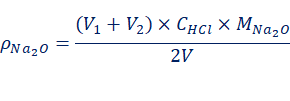
边学边练
用盐酸溶液滴定Na2CO3溶液的第一、第二个化学计量点可分别用()和()作指示剂。产物分别为( )和( )
教师解析:答案为酚酞,甲基橙,NaHCO3,Na2CO3。
少量盐酸时HCl+Na2CO3=NaHCO3+NaCl
当盐酸刚好时,HCl+Na2CO3=NaCl+H2O+CO2↑
