当前位置:课程学习>>第七章 醋酸电离度和电离常数的测定>>知识讲解>>文本学习>>知识点一
知识点二
该部分内容主要让同学们学习实验内容、数据处理、问题讨论。实验内容是同学们验证所学理论知识,得出结论所需的必要过程;数据处理是对原理公式进行运用;问题讨论是对整个实验的总结和注意事项的思考。
一. 实验内容
1.醋酸溶液浓度(由实验准备教师提供醋酸溶液的准确浓度)
c= 0.2 mol·L-1
2.配制不同浓度的醋酸溶液
用吸管分别吸取 25.00 mL、5.00 mL、2.50 mL 已测得准确浓度的醋酸溶液,把它们分别置于三个 50 mL 容量瓶中。再用蒸馏水稀释到刻度,摇匀,并计算出这三瓶醋酸溶液的准确浓度。
3.测定醋酸溶液的 pH 值,并计算醋酸的解离度和解离常数
把以上四种不同浓度的醋酸溶液分别适量倒入 4 只洁净干燥的 50 mL 烧杯中,按由稀到浓的次序在 pH 计上分别测定它们的 pH 值,记录数据和室温。计算解离度和解离常数。
二.数据处理a
不同浓度HAc 溶液的解离度和解离常数 (温度_________℃)
表1 不同浓度 HAc 溶液的解离度和解离常数 温度_________℃
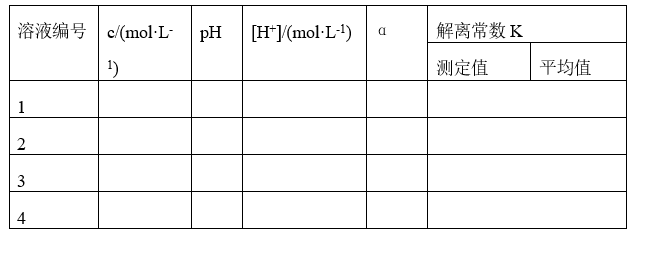
本实验测定 KHAc值在1.0×10-5~2.0×10-5范围内合格(文献值1.7×10-5)
三. 问题讨论
1. 烧杯是否必须烘干?
答:烧杯如果不烘干,残留的水份会影响所配制的溶液浓度,从而带来误差。
2. 如果搅拌结束后玻璃棒上带出了部分溶液对测定结果有无影响?
答:没有影响,因为溶液浓度并没有发生变化。
3. 测量时可否不用按照溶液浓度由低到高进行测量?
答:因该按照由低到高进行测量,这样带来的误差较小。
4. 使用酸度计的主要步骤有哪些?
答:主要步骤有:(1)打开电源开关进行预热;(2)进行温度补偿;(3)使用标准溶液进行定位;(4)使用标准溶液进行斜率校正;(5)测量pH值。
