知识点一
一.实验目的
1. 学习启普发生器的工作原理和使用方法
2. 掌握气体的发生、净化等基本原理和操作方法
3. 学习理想气体状态方程式和阿伏加德罗定律
二.实验原理
理想气体状态方程是一个用来描述气体四个基本性质之间关系的方程。表达式为
pV=nRT
式中,p为气体压力( Pa ),V为气体体积 ( m3 ),T为热力学温度 ( K ),R为摩尔气体常数8.314 J·mol-1·K-1,n为气体的物质的量 ( mol )。
根据阿伏加德罗定律,在同温同压下,同体积的任何气体含有相同数目的分子。因此,在同温同压下,同体积的两种气体的质量之比,等于它们的相对分子质量之比,即
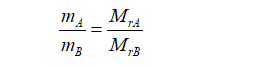
式中,mA、mB、MrA、MrB分别表示两种气体的质量和相对分子质量。
已知空气的平均相对分子质量为29.0,若测得CO2和空气在同温同压条件下的质量,即可求出CO2的相对分子质量( Mrco2 )。
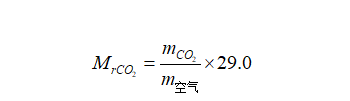
式中,mco2和m空气分别为同体积的CO2和空气的质量。
为了求得mCO2和m空气,可将一个玻璃容器(如锥形瓶)先充满空气,用电子天平称量空气+瓶+塞的质量( m1 ),然后将其充满CO2,并在同温同压下称量CO2+瓶+塞的质量( m2 ),两者的质量之差( m2-m1) 即同体积的CO2与空气的质量之差。
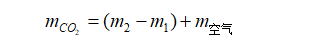
根据实验时测得的大气压( p )、温度( T )和瓶的容积( V ),根据理想气体状态方程,可计算出同体积的空气质量:
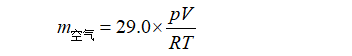
为了求出瓶的容积V,可将瓶内充满水,称量水+瓶+塞的质量(m3 ),m3-m1之差即水与空气的质量之差(m水-m空气),实际上也就是m水(m空气可略去),m水除以水的密度(ρ水=1.00 g·mL-1)即得瓶的容积V,这样CO2气体的相对分子质量Mrco2就可以确定了。
三.仪器与材料
1.仪器
托盘天平、电子天平、启普发生器(带导管旋塞)、洗气瓶(两个)、干燥管、磨口锥形瓶(带玻璃磨口塞)、橡胶管、凡士林、玻璃棉或橡胶垫圈、铁架台、十字夹、铁夹、烘箱。
2.试剂
石灰石、盐酸(6 mol· L-1)、CuSO4溶液(1 mol· L-1)、NaHCO3溶液(1 mol·-1)、无水CaCl2
四.实验预习
1.电子天平的使用
1)电子天平的使用方法
① 使用前,将水平仪中的气泡调至水平仪中央。接通电源,预热至规定时间后,开启显示器。天平进行系统自检,约 2S 后,自检结束,显示称量模式0.0000 g。如果天平显示不是0.0000 g,则需按一下TARE键。
② 将称量物轻放在称盘上,关上天平门,待显示器上数字稳定,并出现质量单位 g 后,即可读数,记录称量结果。称量完毕,取下被称物,关好天平门,轻按ON/OFF键,天平处于待机状态。实验全部结束后,应拔下电源插头,盖上防尘罩。
2)常用的称量方法有直接称量法、固定质量称量法和递减称量法
① 直接称量法。将称量物直接放在天平称盘上直接称量质量。此法适用于称量洁净干燥的器皿,以及不易潮解或升华的固体样品(如金属、合金等)。
② 固定质量称量法(增量法)。固定质量称量法是指称量某一固定质量的样品(如基准物质)。此法称量速度较慢,适于称量不易潮解、在空气中性质稳定的粉末状或小颗粒(最小颗粒质量应小于0.1 mg)样品,不适合称量块状样品。
例如,实验需要准确称取1.4587 g K7Cr2O7。称量步骤如下:① 先准确称取一洁净干燥的小烧杯,并去皮重。② 打开天平侧门,用药匙加K7Cr2O7,于小烧杯中,当天平读数小于但接近1.4587 g时(即样品质量小于1.4587 g),用药匙小心增加样品直到天平读数为1.4587±0.0001即可。
③ 递减称量法(差减法)。递减称量法用于称量一定质量范围的样品。此法适用于一般的粒状、粉末状固体及易吸潮样品等。当用基准物质配制标准溶液时,基准物质的称量一般采用此种方法。
递减称量法使用的称量器皿是称量瓶。称量瓶用前要洗净烘干,称量时不能用手直接拿取称量瓶,应用纸条套住瓶身中部,再用手捏紧纸条,开关瓶盖时,应用纸片夹住称量瓶盖柄,以防手上的汗污等影响称量的准确度。
具体称样方法:将盛有样品的称量瓶放在天平称盘上,准确称量出样品加称量瓶的质量m1。将称量瓶从天平上取出,在盛接样品的容器上方倾斜瓶身,用称量瓶盖轻敲瓶口上部,使样品慢慢落入容器中,当倾出的样品接近所需质量时,一边继续用瓶盖轻敲瓶口上部,一边慢慢地将称量瓶竖起,使粘在瓶口的样品落回称量瓶中,然后盖好瓶盖(上述操作均应在容器上方进行,防止样品丢失),将称量瓶再放到天平称盘上,准确称其质量m2。两次质量之差m1-m2,即为样品的质量。如此继续进行,可称取多份样品。
如果一次倾出的样品不足所需用的质量范围时,可按上述操作继续倾出。如果超出所需的质量范围,不准将已倾出的样品再倒回称量瓶中,此次称量作废,应重新进行称量。
2.气体的发生、净化、干燥与收集
1)气体的发生
实验室制备气体的化学反应,按反应物的状态和反应条件,可以分为四大类:第一类为固体或固体混合物加热的反应;第二类为不溶于水的块状或粒状固体与液体之间不需加热的反应;第三类为固体与液体之间需加热的反应,或粉末状固体与液体之间不需加热的反应;第四类为液体与液体之间的反应,一般需要加热。
① 实验室制备气体的常用装置
制备气体的典型实验装置可分为三大类:第一类是固体加热装置,一般由硬质试管、带玻璃导管的单孔塞、铁架台(包括铁夹)、加热灯具(酒精灯或煤气灯)等组成,通常实验室用此装置制取O2、NH3、N2等气体。第二类是不溶于水的块状或粒状固体与液体常温下反应的装置,一般使用启普发生器。启普发生器主要由球形漏斗、葫芦状的玻璃容器和导管旋塞三部分组成,当导管旋塞打开时,固体与液体接触发生反应,产生的气体由导管导出;当导管旋塞关闭时,由于装置是密闭的,产生的气体使球体内的压力增大,将液体压至半球体及球形漏斗内,使液体与固体不再接触而停止反应。下次使用时,只要重新打开旋塞即可,十分方便。气体流速可通过调节旋塞来控制。通常实验室用启普发生器制取H2、CO2、H2S等气体。第三类是固体与液体或液体与液体之间需加热或不需加热的反应装置,可用合适的蒸馏烧瓶、分液漏斗、单孔(双孔)塞、玻璃导管、橡胶管、铁架台(包括铁夹、铁圈、石棉网等),以及加热灯具组装而成。通常实验室用此装置制取Cl2、HCl、CO和SO2等气体。
② 启普发生器的使用方法
启普发生器不能加热,装在发生器内的固体必须是颗粒较大或块状的固体。移动启普发生器时,应用两手握住球体下部,切勿只握住球形漏斗,以免葫芦状容器落下而打碎。
a.装配。球形漏斗管的下部(处于葫芦状容器的细腰稍上部位)缠一些玻璃棉,以防止固体掉入下面半球体的溶液中。在球形漏斗与球体的磨口处,及玻璃旋塞磨口处要均匀涂一层凡士林,以防止漏气。将葫芦状容器的导气管胶塞和液体出口胶塞塞好。
b.检查气密性。打开导气管旋塞,从球形漏斗口注水至充满半球体时,关闭旋塞。继续加水,待水从漏斗管上升到漏斗球体内,停止加水。静置片刻,如果球形漏斗内的水面不下降,证明气密性好,可以使用。
c.加试剂。固体试剂从气体出口处加入,加入固体的量不宜过多,以不超过中间球体容积的1/3为宜。否则固液反应激烈,液体很容易被气体从导管冲出。液体试剂从球形漏斗加入,在打开旋塞的情况下,加入液体试剂的量以刚好浸没固体试剂为宜。
d.发生气体。使用时,打开旋塞,液体试剂从半球体内进入中间球体,与固体接触而产生气体。停止使用时,关闭旋塞,由于中间球体内产生的气体增大了压力,气体就会把液体从中间球体压入球形漏斗内,固体与液体不再接触,反应停止。下次再使用,只要重新打开旋塞即可。启普发生器的自控作用是依靠生成气体的压力,使用非常方便,还可通过调节旋塞来控制气体的流量。
e.添加或更换试剂。需要添加或更换固体时,先关闭旋塞,将液体压入球形漏斗中,然后用塞子将球形漏斗上口塞紧,将导气管胶塞取下,添加或者更换固体试剂。更换液体试剂时,可先用塞子将球形漏斗上口塞紧,然后将液体出口的塞子取下,让废液缓缓流出,全部流出后,将葫芦状容器洗净,重新添加液体试剂。
实验结束后,将废液倒入废液缸内(或回收),剩余固体(如锌粒)倒出洗净回收。仪器洗净后,在磨口处夹上纸条,防止时间过久磨口黏结。
2)气体的净化和干燥
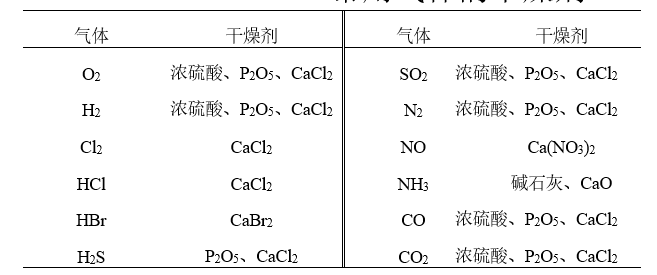
实验室制备的气体常常带有酸雾和水汽,所以在对气体纯度要求较高的实验中需要净化和干燥。通常使用洗气瓶和干燥塔(或干燥瓶)等仪器,选用特定试剂来达到气体净化和干燥的目的。一般是气体先用水洗以除去酸雾,然后再通过浓硫酸(或无水CaCl2或硅胶等)除去水汽。例如,CO2的净化和干燥就可以采用上法。H2的净化则要复杂一些,因为制备H2的原料(Zn粒)中常含有S、As等杂质。所以在H2产生过程中常夹杂有H2S、AsH3等气体,常要求通过KMnO4溶液、Pb(As)2溶液除去,最后再通过浓硫酸干燥。对具有还原性或碱性的气体则不能用浓硫酸干燥,如H2S、NH3等。总之,不同性质的气体应根据具体情况,分别采用不同的干燥剂进行处理。
常用气体的干燥剂
3)气体的收集
普通化学实验中气体的收集方法有排气集气法和排水集气法两种。排气集气法又分为向上排气集气法和向下排气集气法。在水中难溶的气体(如O2、H2、N2、CO、CH4等),可用排水集气法收集。易溶于水且比空气轻的气体(如NH3等),可用向下排气集气法收集。易溶于水且比空气重的气体(如CO2、Cl2等),可用向上排气集气法收集。
凡能用排水集气法收集的气体就尽量用排水集气法来收集,因为排水集气法收集的气体浓度大、纯度高。面排气集气法收集的气体总含有空气。收集、储备较大量易爆气体,不宜用排气法收集,因为可燃性气体混入空气后,如达到爆炸极限,点火即可爆炸。
4)实验装置气密性检验
气密性检验一般应在仪器连接完之后 、添加药品之前进行。气密性检验的方法虽然多种多样,但总的原则如下:堵死一头(即通过气体发生器和附设的液体构成密封体系),采取一定的措施(如升温、加压、吹气等),导致系统内外压力不同,然后观察现象(如气泡的产生、水柱的形成、液面的升降等),从而判断仪器装置的气密性是否良好。若连接的仪器很多,应分段检查。
3.有效数字及运算规则
1)有效数字
① 有效数字的概念。有效数字是测量中实际能够测到的数字,它是测量结果的大小及精确度的真实记录。有效数字中只有最后一位数字是估计的,其余都是准确的。究竟要取几位有效数字,应根据测量仪器和观察的精确程度来决定。例如,在托盘天平上称量物体得 12.4 g,由于托盘天平可称至 0.1 g,因此该物体质量为 12.4 g ± 0.1 g,其有效数字是3位。在电子天平上称量物体得(6.4134 ± 0.0001)g,其有效数字是 5 位。常用的滴定管最小刻度是 0.1 mL,数据可读取并记录为 23.25 mL,表示该液体体积为(23.25 ± 0.01)mL,其有效数字是 4 位。因此,有效数字中的最后一位数字是可疑数。任何超过或低于仪器准确程度的数字都是不恰当的。例如,上述滴定管的读数为 23.25 mL,不能当作23.250mL,也不能当作 23.3 mL。前者夸大了实验的准确度,后者则降低了实验的准确度。
② 有效数字位数的确定。
a.有效数字的位数与小数点无关。
b.“0”在数字前面,只表示小数点的位置,不包括在有效数字中;如果“0”在数字的中间或末端,则表示一定的数值,应包括在有效数字的位数中。
c.采用指数表示法,10n不包括在有效数字之中。对于很大或很小的数字,采用指数表示法更为简便合理。
d.对数值的有效数字位数,仅由小数部分的位数决定,整数部分只说明该数的方次数。例如,pH=7.68,则[H+]=2.1×10-8 mol·L-1,其有效数字为 2 位,而不是[H+]=2.09×10-8 mol·L-1。
e.若数据的首位数字大于8时,则有效数字的位数可以多算一位。例如,8.76可看作4位有效数字。
2)有效数字的运算规则
在处理数据时,有效数字的取舍很重要,它有助于避免因计算过繁而引起的错误,确保运算结果的正确性,同时也可以节省时间。有效数字的基本运算法则:
① 记录和计算结果所得的数值,均只能保留一位可疑数字。
② 当有效数字的位数确定后,其余的尾数应根据“四舍五入”或“四舍六入五留双”的规则取舍。
③ 加减法的运算规则 几个数相加或相减时,其和或差的小数点后位数应与参加运算的数字中小数点后位数最少的那个数字相同。例如:0.0121 + 1.0568 + 25.64 = 26.71
显然这三个数值之和应保留到小数点后第 2 位,因为第三个数值 25.64 中的“4”已经是可疑数字,再留小数后的第 3 位甚至第 4 位数字是没有意义的。
④ 乘除法的运算规则 在乘除运算中,计算结果的有效数字的位数,应与各数值中最少的有效数字的位数相同。例如:5.44 × 0.48 = 2.6
因参加运算的数字中有效数字位数最少的是 0.48 ,只有 2 位,故计算结果的有效数字也应为 2 位,即 2.6。
在进行一连串数值的乘除中,为了简便起见,在进行乘除前可先将各数按“四舍五入”的规则或“四舍六入五留双”的规则简化,弃去过多的没有意义的数字。例如,在乘除法中可使各数值中各有效数字的位数与最少的有效数字的位数相同。如 0.0121、1.0568 和 25.64 三个数值相乘,其积应为 0.0121 × 1.06 × 25.6 = 0.328
⑤ 只有在涉及直接或间接测定的物理量时才考虑有效数字。对于像Π、e及手册中查到的常数,可以认为其有效数字的位数是无限的,不影响其他数字的修约,可按需要取适当的位数。一些分数或系数等应视其有足够多的有效数字,可以直接计算,不必考虑其本身的修约问题。
