知识点二
实验内容是同学们验证猜想,得出结论所需的必要过程;数据处理是对原理公式进行运用;问题讨论是对整个实验的总结和注意事项的思考。
一.实验内容及操作步骤
1.CuSO4·5H2O的制备
在托盘天平上称取3.0 g CuO粉末,放入100 mL烧杯中,加20 mL 3 mol·L-1稀硫酸,小火加热,搅样,使黑色的CuO粉末全部与稀硫酸反应,溶液呈蓝色。趁热用倾析法将溶液转移至洁净的蒸发皿中.在水浴上缓慢加热,浓缩至表面有晶膜出现为止。取下蒸发皿,使溶液逐渐冷却至室温,即有蓝色的五水合硫酸铜晶体(粗产品)析出。抽滤,称量,计算产率。
2. 重结晶法提纯CuSO4·5H2O
将粗产品以每克加1.2 mL水的比例溶于蒸馏水中,加热使其完全溶解,并趁热过滤(若无不溶性杂质则不必过滤)。将滤液缓慢冷却,即有晶体析出(若无品体析出,可在水浴上再稍微加热浓缩),抽滤,称量,计算产率。
二.数据处理
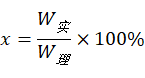
式中:x——CuSO4·5H2O产率; W实——实际上制的CuSO4·5H2O的质量;
W理——通过计算理论上能制得的硫酸铜的质量。即:

三.问题讨论
1. 在什么情况下可用倾析法,什么情况下用常压过滤或抽滤 ?
答:沉淀(晶体)的比重较大或结晶的颗粒较大,静止后能很快沉降,常采用倾析法进行分离。当沉淀物为胶体或微细的晶体时,采用常压过滤较好,但过滤速度较慢。减压过滤可加快过滤速度,并使沉淀抽滤得比较干,但不宜用于过滤颗粒太小的沉淀和胶体沉淀。
2. 如何制备大粒晶体 ?
答:制备大粒晶体的一般条件是溶液浓度不能太高,自然冷却,不要搅动。析出晶体颗粒的大小与结晶时的条件有关。如果溶液的浓度高,溶质的溶解度小,冷却得快,那么析出的晶体就细小。否则,结晶颗粒就较大。搅动或静置溶液,可以得到不同的效果。前者有利于细小晶体的生成,后者有利于大晶体的形成。从纯度的要求来看,细小晶体的生成有利于生成物纯度的提高,因为它不易裹入母液或其它杂质;而较大晶体,特别是聚结成大块的晶体,则不利于纯度的提高。 若溶液容易发生过饱和现象,可用玻棒摩擦器壁或投入几粒小晶体(晶种)等办法,使形成结晶中心,过量的溶质便会全部析出。
3. 哪些情况会造成产品收率过高 ?
答:1) 除杂加试剂量多导致产率偏高;2) 过滤滤纸有破损,有些杂质就进入了滤液中,形成精盐的质量增加导致产率偏高;3) 过滤后液体尚浑浊时,就进行蒸发水份,导致产率偏高; 4) 滤液高于滤纸边缘,会使没有过滤的液体进入滤液,导致精盐含有一定杂质质量增加,产率偏高。5) 蒸发结晶时,看到晶体析出立即停止加热,余热没有把精盐干燥直接称量产率偏高产。
