第十一章 极谱分析法
 知识点三:极谱波的类型及其方程式
知识点三:极谱波的类型及其方程式
一.极谱波的类型
(一)按电极反应的可逆性区分
极谱波可以分成两类:可逆波与不可逆波。其根本区别在于电极反应是否表现出明显的过电位,也就是是否表现出电化学极化。
1.可逆波 电极反应速度很快,极谱波上任何一点的电流都是受扩散速度控制,成为扩散电流。在这里,电极反应的进行没有明显的过电位,能斯特非常完全适用,即在任一电位下,电极表面均能迅速达到平衡。可逆极谱波的波形一般是很好的,如图11-12曲线1。
2.不可逆波 电极反应速度比扩散速度慢,极谱波上的电流不完全由扩散速度所控制,而是受电极反应速度所控制。要使电活性物质在电极上反应产生电流,就需要一定的活化能,也就是要增加额外的电压,表现出明显的过电位。因此,不能简单地应用能斯特公式。不可逆极谱波的波形较差,延伸较长,如图11-12曲线2。

图11-12 可逆波和不可逆波(1-可逆波;2-不可逆波)
当电极电位不够负时,没有明显的电流通过(曲线AB段),当电位向更负的方向增加时,过电位逐渐被克服,电极反应速度加快,电流随之增加(曲线BC段)。当电位足够负时,过电位被完全克服,此时电流已完全为扩散所控制,达到极限电流(曲线CD段)。可逆和不可逆极谱波的半波电位之差,即为不可逆过程所需的过电位。
值得注意的是,在实际情况下,可逆波与不可逆波并无截然的界限,在一定条件下,二者可以互相转化,可以选择合适的底液,使其转化为可逆波或增加其可逆性。
(二)还原波和氧化波
1.还原波(阴极波) 还原波是氧化态物质在滴汞电极上还原所得到的极谱波。其电极反应如下:
![]()
图11-13中曲线1为还原波。
2.氧化波(阳极波) 氧化波是还原态物质在滴汞电极上氧化所得到的极谱波。电极反应如下
![]()
图11-13中曲线2为氧化波。如果一种物质在相同底液中,其还原波和氧化波的半波电位相同,那么它的极谱波是可逆的(图11-13中曲线1与2)。
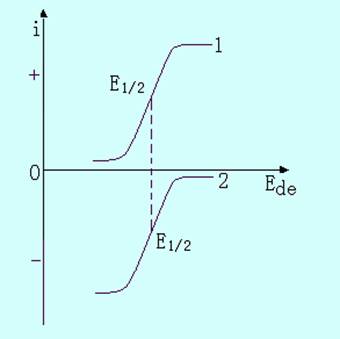
图11-13 还原波与氧化波
二.极谱波方程式
描述极谱图中任意一点的电流与对应的电极电位关系的方程式称为极谱波方程式。不同反应类型的极谱波具有不同的方程式。下面仅讨论可逆电极反应中简单金属离子的极谱波方程式。
当金属离子Mn+在滴汞电极上还原为金属并生成汞齐时,其电极反应为
![]()
假定电极反应是可逆的,迁移电流已消除,则滴汞电极的电位为:
![]() (11-11)
(11-11)
式中Cs为金属离子在电极表面的浓度,Ca为金属在汞齐中的浓度。
根据扩散电流方程式可得:
![]() (11-12)
(11-12)
在未达到极限扩散电流以前,扩散电流为:
![]() (11-13)
(11-13)
上两式中c0为金属离子在本体溶液中的浓度,Ks为比例常数,25C时为607nDs1/2m2/3t1/6 。由式(11-12)及(11-13)可得
![]() (11-14)
(11-14)
另外,还原产物的浓度(即金属在汞齐中的浓度)也与通过的电流成正比,得
![]() (11-15)
(11-15)
式中Ka为607nDa1/2m2/3t1/6。将式(11-15)及(11-14)代入式(11-11)得![]()
![]() (11-16)
(11-16)
由此可见,在一定条件下,任一物质的可逆极谱波的半波电位是一个常数,与浓度无关。因此,半波电位在理论上可以用来进行定性分析,但因极谱波的重叠及干扰,实际上极谱定性分析很少被采用。可是半波电位对于设计定量分析方法是很重要的,在确定极谱记录的电压范围内,底液的选择及排除干扰方法的选择都要参考半波电位。
可逆极谱波方程式为
![]() (11-17)
(11-17)
若将Ede对 作图,可得一直线,据此可用作图法求得E1/2和n值,这一方法叫做极谱波对数分析(图11-14)。
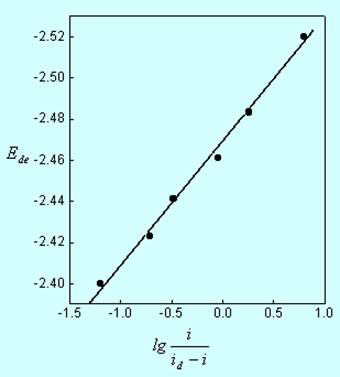
图11-14极谱波的对数分析
