第十一章 极谱分析法
 知识点二:极谱定量分析
知识点二:极谱定量分析
一.扩散电流方程式
扩散电流方程式是指扩散电流与在滴汞电极上进行电极反应的物质浓度之间的定量关系。式(11-4)中的比例常数K包括了影响扩散电流的各因素,其表达式为:
![]() (11-7)
(11-7)
扩散电流方程式 ![]() (11-8)
(11-8)
式中:n为电极反应中的电子转移数;D为被测组分的扩散系数(cm2∙s-1);m为汞滴流速(mg∙s-1);t为滴下时间(s);c为被测物质浓度(mmol∙L-1);id为平均极限扩散电流。
式(11-8)称为尤考维奇(lkovic)方程式,K称为尤考维奇常数。由式(11-8)可见,在一定实验条件下,平均极限扩散电流与被测物质的浓度成正比,这是极谱定量分析的依据。
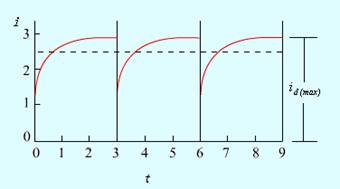
图11-5 扩散电流随时间的变化
二.影响扩散电流的因素
在极谱分析中,只有保持扩散电流方程式中的常数项K不变,才能使极限扩散电流与被测物质的浓度成正比。影响K值的因素有以下几项。
(一)毛细管特性
从扩散电流方程式来看,id与m2/3t1/6成正比,因此m与t的任何改变都会引起扩散电流的变化。m与t均为毛细管特性,m2/3t1/6称为毛细管常数。
汞流速度m与汞柱压力p成正比,即
![]()
而滴下时间t则与汞柱压力成反比,即
![]()
于是 ![]()
由于 ![]()
所以 ![]()
也就是说,扩散电流与汞柱压力的平方根成正比。一般作用于滴汞上的压力是以贮汞瓶中的汞面与滴汞电极末端之间的汞柱高度h (cm)来表示。因此
![]() (11-9)
(11-9)
所以在实际操作中,应该保持汞柱高度不变。通常汞柱高度每增加1cm,扩散电流约增加2%。在分析标准溶液与未知试样时,要用同一支毛细管,并在同样的汞柱高度下记录极谱图,才能得到准确的结果。
另外,扩散电流与汞柱高度的平方根成正比的关系是受扩散速度控制的电极反应的一个特征,可用来检验电极反应是否受扩散速度控制。
(二)温度的影响
在扩散电流方程式中,除了n以外,其他各项都受温度影响,但主要是D受温度影响。实验证明,溶液的温度升高一度,扩散电流增加1.3%。因此在测定过程中,必须将温度控制在0.5 C范围内,以使扩散电流因温度变化所引起的误差不大于1%。
(三)溶液组分的影响
从扩散电流方程式可知,扩散电流与扩散系数D1/2成正比,而扩散系数D与溶液的粘度有关。粘度越大,物质的扩散系数越小,因此扩散电流也随之减小。溶液组分不同,其粘度也不同。所以在极谱分析中,要求保持标准溶液和试样溶液的组分基本上一致。
三.干扰电流及消除方法
在极谱分析中,除了扩散电流以外,还有其它因素引起的非扩散电流。这些电流与被测离子浓度无关或不成比例,它们的存在将干扰测定。因此,实验时必须选择适当的方法消除这些干扰。
(一)残余电流
在电解过程中,外加电压虽未达到被测物质的分解电压,但仍然有微小的电流通过电解池,这种电流称为残余电流。残余电流由两部分组成:一部分是电解电流,另一部分是充电电流。电解电流是被测溶液中含有易在滴汞电极上还原的杂质引起的,例如,溶解在溶液中的微量氧,蒸馏水中微量的铜等。充电电流是残余电流的主要部分,也是影响极谱分析灵敏度的主要因素,其产生原因可解释如下。
电解池中装有已除氧的0.1 mol/L KCl溶液,将滴汞电极和甘汞电极插入其中,如将滴汞电极和甘汞电极短路,则滴汞电极将具有甘汞电极的电位。甘汞电极中的汞层与其相接触的氯化亚汞、氯化钾溶液的界面之间有双电层,汞带正电荷,溶液则带负电荷。当两者短路后,甘汞电极便向滴汞表明充以正电荷,溶液则带有负电荷,在界面上形成双电层。如果在两极间施加外加电压使滴汞电极的电位逐渐变负,电子便从电源负极流入滴汞电极,于是汞表面带的正电荷便逐渐减少。当滴汞电极的电位达到某一值时,汞滴表面不带电荷,称为零电荷电位。再继续增加外加电压使滴汞电极的电位更负时,汞滴表面就带负电荷,并从溶液中吸引相当量的正离子到表面附近,形成符号相反的双电层。
因此,当滴汞电极的电位正于零电荷电位时,应向汞滴充以正电荷,因此便有电流从甘汞电极经外电路流向滴汞电极;在零电荷电位时,汞滴不带电荷,电流为零;当滴汞电极的电位负于零电荷电位时,应向汞滴充以负电荷,因此便有电流从滴汞电极经外电路流向甘汞电极,这就是充电电流。图11-6是电解0.1 mol/L KCl溶液得到的充电电流曲线。
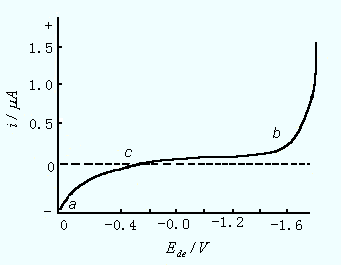
图11-6 0.1 mol/L KCl溶液的充电电流
对于面积固定的静止电极来说,当两个电极短路时的电位达到相等时,电荷便停止充入,充电电流是瞬时的。但是滴汞电极的面积是不断改变的,因此必须连续不断地向滴汞充以正电或负电,才能使其表面具有相当于该电位时所应有的电荷密度值。这样便形成了连续不断的充电电流。如果在电极上发生电极反应,那么在电解电流上同时叠加了充电电流。
充电电流的大小为10-7数量级,相当于浓度为10-5 mol/L物质所产生的扩散电流,这就限制了极谱分析法的灵敏度,为了解决充电电流的问题,促使新的极谱技术的发展,如方波极谱、脉冲极谱等,就是在这一基础上发展起来的。在测量扩散电流时,对残余电流一般采用作图的方法加以扣除。
(二)迁移电流
迁移电流来源于电解池的正极和负极对被分析离子的静电吸引力或排斥力。例如用极谱分析法测定Pb2+,Pb2+在滴汞电极上还原,由于浓差极化,使得溶液中Pb2+受到扩散力作用而向电极表面附近扩散,产生扩散电流。此外,作为负极的滴汞电极对正离子的静电吸引作用,使有更多的Pb2+趋向电极表面而被还原而产生的电流称为迁移电流。因而观察到的总极限扩散电流比只有扩散时为高。迁移电流与被测物质的浓度无定量关系,故应加以消除。
消除迁移电流的方法是在溶液中加入大量支持电解质(如KCl,NH4和KNO3 等),它们在溶液中电离成阳离子和阴离子,电解池的负极(滴汞电极)对阳离子有静电引力,因此,作用于被测离子的静电引力就大大减小,从而达到消除迁移电流的目的。但必须注意的是,加入的支持电解质是在测定条件下不发生电极反应的惰性电解质,一般支持电解质的浓度要比被测物质浓度大50~100倍。
(三)氧波
在普通极谱法中,氧是干扰最大的元素。在室温和常压下,氧在水溶液中的溶解度是10~20 mg∙L-1,溶解氧在滴汞电极上很容易被还原,产生两个极谱波,电极反应如下:
![]()
![]()
它们的半波电位分别为-0.20 V及-0.80 V。这两个极谱波覆盖在一个较宽的电压范围内,这是极谱分析最有用的电位范围,干扰很大,应设法消除(图11-7)。
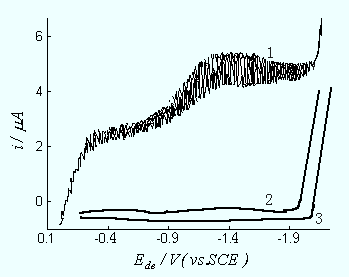
图11- 7 溶液的极谱图(1-用空气饱和的,出现氧的双波;2-部分除氧;3-完全除氧)
常用的除氧方法有下列两种:
1.通气除氧 向溶液中通入惰性气体,如高纯N2、H2等,可使溶液中的氧驱除干净,从而消除氧波。
2.加入亚硫酸钠 中性或碱性溶液中,SO32-很容易被氧化成SO42-,加入Na2SO4可除去溶液中的氧,反应式如下:![]()
过量的SO32-和生成的SO42-对极谱测定无影响,但当溶液为酸性时,SO32-亦可在电极上还原产生极谱波,故不适用。
(四)极谱极大
在极谱分析中,常有一种特殊的现象发生,即在电解开始后,电流随电位的增加迅速增大到一个极大值,然后下降到扩散电流区域,电流恢复到正常,见图11-8。这种电流-电位曲线上出现比扩散电流要大得多的电流峰,称为极谱极大。极谱极大的高度与被测物质浓度之间并无简单的关系,又影响扩散电流和半波电位的准确测量,故应加以消除。
加入极大抑制剂可消除极谱极大,常用的极大抑制剂有明胶、聚乙烯醇、曲通-100等。加入极大抑制剂的量不能太多,否则将影响扩散电流。实验证明,极大抑制剂的用量一般在0.002%~0.01%范围内较合适。
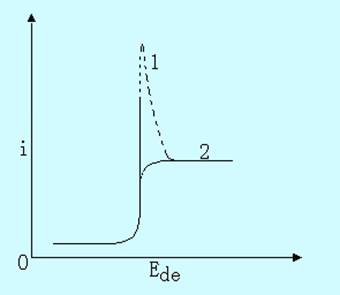
图11-8 极谱极大(1-不加明胶;2-加明胶)
(五)叠波、前波和氢波
1.叠波 两种物质的极谱波的半波电位如果相差太小(小于0.2 V),这两个极谱波就会重叠起来,影响扩散电流的测量。为了消除叠波现象,可加入适当的络合剂,改变它们的半波电位,使两个波分开,或采用化学分离的方法,除去干扰物质。
2.前波 如果被测物质的半波电位很负,而溶液中又存在大量的半波电位较正易还原的物质,尽管它们的半波电位相差较大,但由于该物质产生一个很大的前波,因而掩盖了后还原物质的极谱波,使之无法测定。这种干扰称为前放电物质的干扰。
在极谱分析中,经常遇到的前放电物质是Cu2+与Fe3+ ,在没有适当的络合剂存在的情况下,它们在很正的电位时就开始还原,影响很大。前波的干扰一般采用化学方法加以消除。如在酸性溶液中加入还原铁粉,使Cu2+称为金属铜析出,将Fe3+还原为半波电位很负的Fe2+,从而消除干扰。
3. 氢波 在酸性溶液中,氢离子在-1.2~1.4 V(视酸度高低)范围内还原,产生很大的还原电流,所以半波电位接近或超过-1.2 V的物质不能测定。例如钴、镍和锰等金属离子的半波电位较负,不能在酸性溶液中测定,一般应在碱性溶液中进行测定。
四.定量分析方法
在极谱图上,极限电流减去残余电流后即得与溶液中被测离子浓度成正比的极限扩散电流。由极限扩散电流的大小,可计算出被测物质的含量。
(一)极谱波高的测量
在极谱分析中,极限扩散电流的大小可以用极谱波的波高来表示,而不必测量扩散电流的绝对值。测定波高的方法有很多种,但最常用的是三切线法,它适用于各种极谱图形的测量。测量方法如下:先通过残余电流、极限电流和扩散电流的锯齿形振荡中心分别作出它们的切线AB、CD、和EF,使它们相交于O点和P点,再通过O和P点分别作平行于横坐标的平行线,平行线的间距h即为波高(图11-9)。
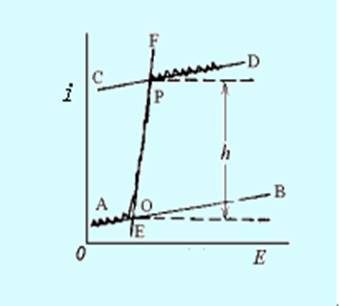
图11-9 三切线法测量波高
(二)极谱定量方法
1.标准曲线法
此法系先配制一系列浓度不同的标准溶液,在相同的实验条件下(即相同的低液、同一根毛细管等)分别测定各溶液的波高(或扩散电流),见图11-10,绘制波高-浓度曲线,然后在同样的实验条件下,从标准曲线上差出相应的浓度。此法适用于大批量同一类型的试样分析,但实验条件必须一致。
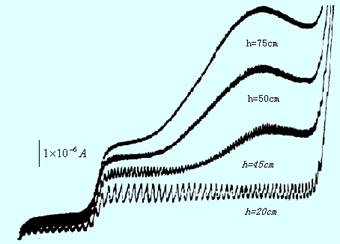
图11-10 标准曲线法
2.标准加入法
标准加入法适用于个别样品的分析。测定时,首先记录体积为V的未知溶液(浓度为c)的极谱图,如图11-11中的曲线1,测得其波高h。然后加入一定体积(Vs)的被测物质的标准溶液(cs),在同一条件下再记录极谱图(曲线2),测得波高为H。由扩散电流方程式得:![]()
![]()
由以上两式可得未知溶液的浓度为:
![]() (11-10)
(11-10)
一般当试液的体积为10 mL时,加入标准溶液的量以0.1~1.0 mL为宜,并使加入后的波高增加0.5~1倍。由于加入标准溶液前后试液的组成基本保持一致,基本上消除了底液不同所引起的误差,所以方法的准确度较高。但应注意,采用标准加入法有一个前提,即波高与浓度成正比,也就是校准曲线应通过原点时才能使用。
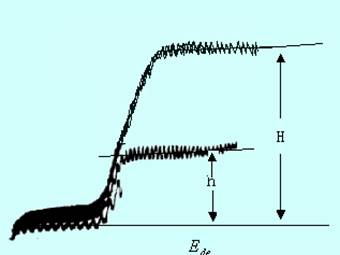
图11-11 标准加入法
