第九章 电位分析法
 知识点一:离子选择性电极的分类及响应机理
知识点一:离子选择性电极的分类及响应机理
一、离子选择电极分类
离子选择性电极(Ion Selective Electrode)也称离子敏感电极,它是一种化学传感器,其主要部件是一个敏感膜。敏感膜是指一个能分开两种电解质溶液的连续层,它对电极的电位响应和选择性起着决定性的作用。
离子选择电极有不同种类,1975年IUPAC(国际纯粹与应用化学联合会)推荐将其作如下分类:
二、 玻璃电极
(一)玻璃电极的构造
玻璃电极是出现最早的膜电极。它的核心部分是玻璃膜,这种膜是在SiO2基质中加入NaO2和少量CaO烧制而成的,膜厚度0.5mm,呈球泡形。球泡内充注0.1mol·L-1的盐酸作为内参比溶液,再插入一根Ag/AgCl电极作内参比电极。由于玻璃电极的内阻一般都很高(50~500MΩ),导线及电极引线应带有屏蔽层及良好的绝缘,在支持杆引出线一端用胶木帽及粘接剂封闭牢固,即成为一支玻璃电极(图9-1)。
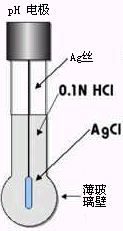
图9-1 玻璃电极结构图
(二)玻璃电极的响应原理
早在20世纪初,人们就发现特定组分的玻璃对氢离子有电位响应,对其相应的机理已经研究多年。大量的实践证明,玻璃膜的化学组成对电极的性能影响很大,纯SiO2制成的石英玻璃就不具有响应氢离子的功能,这是因为石英玻璃中的硅和氧以共价键结合:
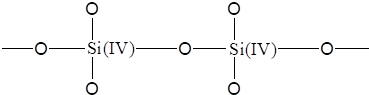
没有可供离子交换用的电荷质点(即点位),不能完成传导电荷的任务,因此,石英玻璃对氢离子没有响应。然而,如果在石英玻璃中加入碱金属的氧化物(如Na2O),将引起硅氧键断裂形成荷电的硅氧交换点位:
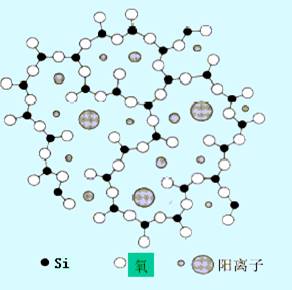
图9-2 硅酸盐玻璃的结构
当玻璃电极浸泡在水中时,溶液中氢离子可进入玻璃膜与钠离子交换而占据钠离子的点位,交换反应为:
![]()
此交换反应的平衡常数很大,这主要是因为硅氧结构与氢离子的键合强度远大于其钠离子的强度(约为1014)的缘故。由于氢离子取代了钠离子的点位,玻璃膜表面形成了一个类似硅酸结构的水化胶层。在水化胶层的最表面,钠离子点位全部被氢离子占有,从水化胶层表面到水化胶层内部,氢离子占有的点位逐渐减少,而钠离子占据的点位逐渐增多,到玻璃膜的中部即是干玻璃层,全部点位被钠离子占有。图9-3显示了玻璃膜表面与内部离子的分布情况。
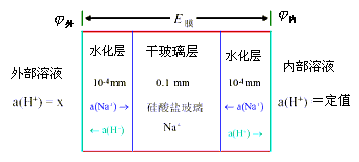
图9-3 水化敏感玻璃分层模型
当被氢离子全部占有交换点位的水化胶层与试液接触时,由于它们的氢离子活(浓)度不同就会发生扩散,即:![]()
当溶液中氢离子活(浓)度大于水化胶层中的氢离子活(浓)度时,则氢离子从溶液进入水化胶层,反之,则氢离子由水化层进入溶液,氢离子的扩散破坏了膜外表面与试液间两相界面的电荷分布,从而产生电位差,形成相界电位(E外)。同理,膜内表面与参比溶液两相界面也产生相界电位(E内),显然,相界电位的大小与两相间的氢离子活(浓)度有关,其关系为:
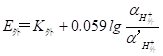 (9-1)
(9-1)
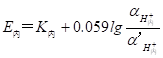 (9-2)
(9-2)
式中: 、 为膜外溶液和膜内溶液的氢离子活度; 、 为外水化胶层和内水化胶层的氢离子活度;K外、K内为玻璃外、内膜性质决定的常数。
对同一支玻璃电极,膜内外表面的性质可以看成是相同的,所以常数项K外和K内是相等的,又因为膜内外水化胶层中可被氢离子交换的点位数相同,所以 = ,因此,玻璃膜内外侧之间的电位差为:
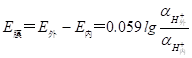 (9-3)
(9-3)
作为玻璃电极的整体,玻璃电极的电位应包含有内参比电极的电位,即:
![]() (9-4)
(9-4)
因为内参比电极为Ag-AgCl,其电位为:
![]() 于是
于是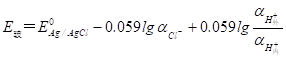 (9-5)
(9-5)
和 为常数,所以上式简化为:
![]() (9-6)
(9-6)
或![]() (9-7)
(9-7)
上式表明,试液的pH每改变1个单位,电位变化59mV,这是玻璃电极成为氢离子指示电极的依据。
(三)玻璃电极的特性
1.不对称电位 如果玻璃膜两侧溶液的pH相同,则膜电位应等于零。但实际上仍有一微小的电位差存在,这个电位差称为不对称电位( ),它是由于玻璃膜内外结构和性质上的差异造成的。玻璃电极可通过长时间浸泡或使用标准缓冲溶液校正的方法减小不对称电位。
2.碱差 用玻璃电极测定pH>10的溶液或钠离子浓度较高的溶液时,测得的pH比实际数值偏低,这种现象称为碱差(或钠差)。碱差是由于在水化胶层和溶液界面之间的离子交换过程中,不但有氢离子参加,而且有钠离子的参加,pH降低。
3.酸差 酸差是指用pH玻璃电极测定pH<1的强酸性溶液时,pH的测定值比实际值高。产生酸差的原因是由于在强酸性溶液中,水分子活度减小,而氢离子是靠H3O+传递的,这样达到电极表面的氢离子减少,pH增高。
(四)pH的测定
用于测量pH的装置如图9-4所示。
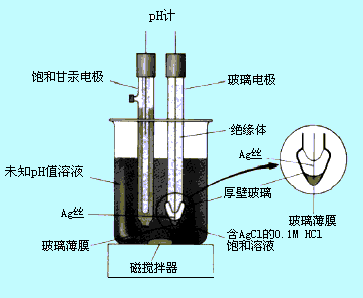
图9-4 测量pH的装置
其中玻璃电极是测量溶液中氢离子活度的指示电极,饱和甘汞电极作为参比电极,两者插入溶液中组成下列电池:
Ag│AgCl,0.1mol·L-1HCl│试液或标准缓冲溶液║KCl(饱和),Hg2Cl2│Hg
在此电池中,电动势可用下式计算:
E电池=ESCE-E玻+E不对称+E液接=ESCE-EAgCl/Ag-E膜+E不对称+E液接
在测定条件下,ESCE、E不对称、E液接及EAgCl/Ag可视为常数,上式可变为:
![]() (9-8)
(9-8)
在实际测定中,溶液的pHx是通过与标准缓冲溶液的pHs相比较而确定的。
若测得pHs的标准缓冲溶液的电动势为Es,则:
![]() (9-9)
(9-9)
在相同条件下,测得pHx的试样溶液的电动势为Ex,则:
![]() (9-10)
(9-10)
由(9-9)和(9-10)可得:
![]() (9-11)
(9-11)
若以pH玻璃电极作为正极,饱和甘汞电极作为负极,则有关系式:
![]() (9-12)
(9-12)
式(9-11)和式(9-12)称为溶液的pH操作定义,亦称pH标度。因此用电位法测定溶液的pH时,先选用标准缓冲溶液定位,然后直接在pH计上读出试液的pH(直读法)。pHs应与pHx接近,可减小误差。
(五)其它玻璃电极
除pH玻璃电极外,还有Na+、K+及Li+等玻璃电极,这些玻璃电极的结构与响应机理和pH玻璃电极相似。电极的选择性主要取决于玻璃膜的组成,只要适当改变玻璃膜组成中的Na2-Al2O3-SiO2三者的比例,电极的选择性就会表现出一定的差异。表9-1列出了某些玻璃电极的组成及性质。
表9-1 某些玻璃电极的组成及选择性
被 测 离 子 |
玻璃膜组成(摩尔比)/% |
选 择 系 数 |
Na+ |
11 18 71 |
KNa+,K+≈2800,pH=11 |
27 5 68 |
KK+ Na+≈20 |
|
15(Li2O) 25 60 |
KLi+, Na+≈3, KLi+, K+≈1000 |
|
28.8 19.1 52.1 |
KAg+, Na+≈105 |
二、 晶体膜电极
晶体膜电极的敏感膜一般都是有难溶盐经过加压或拉制成单晶、多晶或混晶制成的,其中均相膜电极是用单晶体化合物均匀混合物制成。如LaF3单晶,Ag2S/AgI粉末压制成的片等;非均相膜电极的电极膜除了电活性物质外,还加入某种惰性材料,如聚氯乙烯(PVC)、硅橡胶等,其中电活性物质对膜电极的功能有决定性作用。图9-5是用LaF3单晶制成的膜电极。
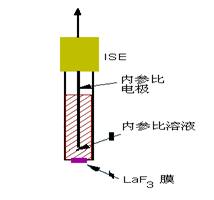
图9-5 氟离子选择性电极
晶体膜中,由于存在晶体缺陷空穴,靠近缺陷空穴的氟离子可移入空穴,氟离子的移动能传递电荷,而La3+固定在膜相中,不参与电荷的传递。由于晶格中缺陷空穴的大小、形状和电荷的分布,只能允许特定的离子进入空穴,其它离子不能进入空穴,因而氟电极对氟离子有选择性响应。
当把氟电极浸入被测试液中时,试液中的氟离子向氟电极表面扩散进入膜相,而膜相中的氟离子也可以进入溶液,形成双电层产生膜电位,其膜电位与膜两侧氟离子活度的关系符合能斯特方程式:
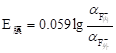 (9-13)
(9-13)
氟电极电位为:
![]() ( 为内参比电极电位) (9-14)
( 为内参比电极电位) (9-14)
当 和 为一定值时,
![]() (9-15)
(9-15)
氟离子选择性电极有较好的选择性,主要干扰离子是OH-,因为在碱性溶液中电极表面发生如下反应:
在较高的酸度下,由于HF和HF2-的生成,使F-离子活度降低。所以在使用氟离子选择性电极时,溶液的pH应控制在5~6之间。
根据式(9- 6)和式(9-15)可知,离子选择性电极法的定量依据是
![]() (9-16)
(9-16)
式中n为被测离子所带的电荷数,因为阳离子所带电荷数为正,所以对阳离子取“+”号,而阴离子则取“-”号。
部分晶体膜电极的性能参数列于表9-2。
表9-2 晶体膜电极
电极名称 |
膜组成 |
检测范围/mol·L-1 |
pH适用范围 |
主要干扰离子 |
氟电极 |
LaF3+Eu2+ |
5×10-7~1×10-1 |
5~6 |
OH- |
四、液膜电极
液膜电极亦称流动载体电极,与玻璃电极不同,其敏感膜不是固体,而是液体。钙离子选择电极是这类电极的一个重要例子,它的构造如图9-6所示。
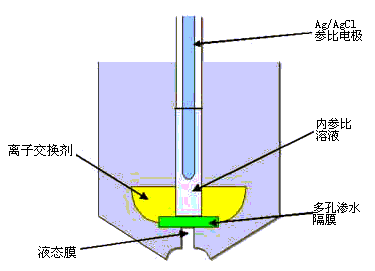
图9-6 液膜电极结构
电极内装有两种溶液,一种是内部溶液(0.1mol•L-1 CaCl2水溶液),其中插入内参比电极(Ag-AgCl电极);另一种是具有可交换点位的溶液离子交换剂。该液体离子交换剂使用二癸基磷酸根[(RO)2PO2]-作载体,与该离子作用生成二癸基磷酸钙[(RO)2PO2]2Ca,再溶于苯基磷酸二辛酯[C6H5PO(C8H17O2)]中制得。将液体离子交换剂浸泡于惰性多孔薄膜(如烧结玻璃)中制成对钙离子响应的敏感膜。敏感膜把内参比溶液和试液隔开,这时在每个界面上发生交换平衡:![]()
这样,就破坏了界面附近原来正负电荷的均匀性,形成双电层,产生膜电位。同样,对于内部溶液与膜相也产生膜电位,若内部溶液中钙的活度与外部溶液中钙
的活度不等,则膜两侧将产生电位差(膜电位),可以推导出,膜电位与试液中Ca2+的活度有如下关系:
![]() (9-17)
(9-17)
该电极可测定1×10-5molL-1的Ca2+,一些常用的液膜电极如表9-3所示。
表9-3 液膜电极及其性能
电极 |
膜组成 |
线性响应范围/mol•L-1 |
主要干扰离子 |
Ca2+ |
二癸基磷酸钙溶于苯基磷酸二辛酯 |
1×10-5~1×10-1 |
Zn2+,Mn2+,Cu2+ |
NO3- |
四(十二烷基)硝酸铵 |
5×10-6~1×10-1 |
NO2-,Br-,I-,ClO4- |
ClO4- |
邻二氮菲杂铁(Ⅱ)络阳离子 |
1×10-5~1×10-1 |
OH- |
BF4- |
三庚基十二烷基氟硼酸铵 |
1×10-6~1×10-1 |
I-,SCN-,ClO4- |
五、气敏电极
气敏电极是一种气体传感器,常用于分析溶解于水溶液中的气体。它的作用原理,是利用待侧气体与电解质溶液发生反应,生成一种离子选择性电极有响应的离子。由于这种离子的活度(浓度)与溶解的气体量成正比,因此,电极响应直接与试样中气体的活度(浓度)有关。如CO2溶于水时,发生如下的化学反应:![]()
生成的氢离子可用pH玻璃电极检测。图9-7是CO2气敏电极示意图,它由透气膜、内电解质溶液、指示电极和参比电极组成。透气膜由聚四氟乙烯、聚丙烯和硅胶等材料制成,具有憎水性,但能透过气体,它把内电解质溶液和待侧溶液分开。
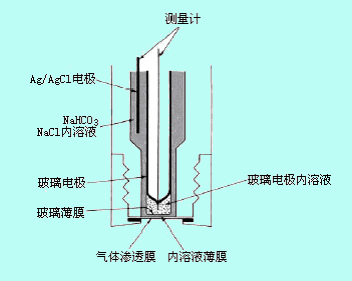
图9-7 气敏电极结构
几种气敏电极及性能列于表9-4。
表9-4 气敏电极的种类及性能
电极 |
指示电极 |
内充电解质 |
化学平衡反应 |
检测限 |
试液pH |
干扰 |
CO2 |
H+ |
0.01mol•L-1NaHCO3 |
CO2+H2O |
10-5 |
<4 |
挥发性铵 |
NH3 |
H+ |
0.01mol•L-1NH4Cl |
NH3+H2O |
10-6 |
>11 |
SO2,CO2 |
NO2 |
H+ |
0.02mol•L-1NaNO2 |
2NO2+H2O |
5×10-7 |
柠檬酸 |
Cl2,NO2 |
SO2 |
H+ |
0.01mol•L-1NaHSO3 |
SO2+H2O |
10-6 |
HSO3- |
O2 |
H2S |
S2- |
柠檬酸缓冲液,pH=5 |
H2S+H2O |
10-8 |
<5 |
|
HF |
F- |
1.0mol•L-1H+ |
HF |
10-3 |
<2 |
|
HAc |
H+ |
0.1mol•L-1NaAc |
HAc |
10-3 |
<2 |
|
Cl2 |
Cl- |
HSO4-缓冲液 |
Cl2+H2O |
5×10-3 |
<2 |
|
六、酶电极
将生物酶涂布在离子选择性电极的敏感膜上,试液中的待侧物质收酶的催化发生化学反应,产生能为离子选择性电极敏感膜所响应的离子,由此可间接测定试液中物质的含量。图9-8为酶传感器响应原理图。
由于酶的专一性强,故酶电极的选择性比较好,加上它可以测定一些生化体系中的物质,所以酶电极很受人们的重视。表9-5列出一些酶电极的组成及特性。
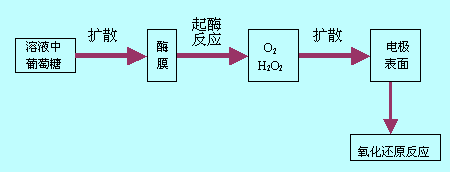
图9-8 酶传感器原理图
表9-5 酶电极的组成及特性
测定物 |
酶 |
酶的催化反应 |
被检物 |
指示电极 |
稳定性 |
检测范围 |
脲 |
脲 酶 |
(NH2)2CO+2H2O→ |
NH4+ |
铵电极 |
2周 |
5×10-5~1×10-2 |
青霉素 |
青霉素酶 |
青霉素+H2O→ |
H+ |
pH电极 |
3周 |
10-4~10-2 |
葡萄糖 |
葡萄糖 |
葡萄糖+O2+H2O→ |
O2,H2O2 |
铂电极 |
1周 |
1×10-4~2×10-2 |
尿 酸 |
尿酸酶 |
尿酸+O2+H2O→ |
CO2 |
气敏电极 |
4个月 |
10-4~10-2 |
乳 酸 |
乳酸脱 |
乳酸+NAD+→ |
H+ |
pH电极 |
<1周 |
10-4~2×10-3 |
