第八章 电化学分析法导论
 知识点三:电极电位与液体接界电位
知识点三:电极电位与液体接界电位
任何电极上都有带电粒子经过两相界面的迁移。电极电位是由两相中电荷密度差造成的。
对于给定的电极反应
![]() (8-5)
(8-5)
其电位可以用Nernst方程式表示
![]() (8-6)
(8-6)
25℃、稀溶液时,用浓度代替活度,式(8.6)可改写为
![]() (8-7)
(8-7)
电极电位是离子活度(浓度)的函数。电对的电位越高,其氧化态的氧化能力愈强;电对的电位越低,其还原态的还原能力愈强。作为一种氧化剂,它可以氧化电位较它低的还原剂;作为一种还原剂,它可以还原电位比它高的氧化剂。根据有关电对的电位,可以判断反应进行的方向和顺序。
E0为标准电极电位,它的测定条件是25℃,氧化态和还原态的活度都等于1,或比值为1,气压为1.023×105Pa(一个大气压),相当于标准氢电极的电位。
例1:计算下列电池电动势,说明电池反应的极性和自发反应的方向。该电池是否原电池?
Zn│Zn2+(5.0◊10-4mol·L-1)││Fe(CN)64-(2.0◊10-4 mol·L-1), Fe(CN)63-(8.0◊10-4 mol·L-1)
解:已知![]()
![]()
![]()
![]()
![]()
![]()
![]()
Zn2+/Zn为阳极,Fe3+/Fe2+为阴极。反应自左向右自发进行,该电池为原电池。
![]()
二、液体接界电位
在两种不同离子或两种离子相同而浓度不同的溶液界面上,存在着微小的电位差,这种电位差称为液体接界电位,简称液接电位。它是由于离子运动速度不同而引起的。液体接界电位与离子的浓度,电荷数,迁移速度以及溶剂性质有关,其大小一般不超过30毫伏。
例如,0.1 mol·L-1 HCl和0.01 mol·L-1HCl,在两种溶液的接触界面,H+和Cl-均由较高浓度一方向较低浓度一方扩散,如图8-2所示。由于H+在溶液中的扩散比Cl-快得多,所以H+越过界面的比Cl-多。这样,界面右侧出现过量的H+而带正电荷,左侧出现过量的Cl-而带负电荷,因而在液体界面处产生电位差。两种离子扩散达到平衡时,在溶液界面处形成了稳定的电位差,即液体接界电位。
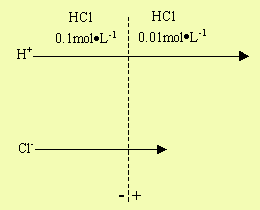
图8-2 液体接界电位的产生
在电位分析法中的直接电位法,液接电位是引起误差的主要原因之一。为了使液接电位减少至几毫伏以下,可在两种溶液之间插入盐桥,以代替原来的两种溶液的直接接触。一般选用阳、阴离子迁移数相近的盐溶液,如饱和KCl溶液。
三、极化和过电位
电流通过电极时,电极电位偏离可逆电极电位的现象称为极化。偏离是由于电极极化造成的(电极电位完全随外加电压而变化)。按照极化产生的原因,可以将极化分为浓差极化和电化学极化。
(一)浓差极化
浓差极化是由于电解过程中,电极附近溶液的浓度和本体浓度发生差别所致。如电解时,阴极发生 的反应。电极表面附近的离子浓度会迅速下降,离子的扩散速率又有限,得不到很快补充。这时阴极电位比可逆电极电位要负,而且电流密度越大,电位负移就越显著。如果发生的是阳极反应,金属的溶解将使电极表面附近的金属离子浓度,在离子不能很快离开的情况下,比主体溶液中的大,阳极电位变得更正一些。这种由浓度差别引起的极化称为浓差极化。要减小浓差极化可采用增大电极面积、减小电流密度、提高溶液温度、加强搅拌等办法。
![]() 小于 平衡值 (阴极) (8-8)
小于 平衡值 (阴极) (8-8)
(二)电化学极化
电化学极化是由某些动力学因素决定的。电极上有电流流过时,电极上发生一系列过程,并以一定速度进行。每一步都或多或少地存在着阻力,要克服这些阻力,相应地需要一定的推动力,表现在电极电位上就出现这样那样的偏离。电化学极化是由于电极反应速度过慢引起的。电极反应是分步进行的,这些步骤中可能有某一步反应速度过慢,需要较高的活化能。
(三)过电位
过电位是极化电极电位与平衡电极电位的差值,一般用η表示。并以ηc表示阴极过电位,ηa表示阳极过电位。极化时,阴极电位更负,阳极电位更正。过电位可衡量电极的极化程度。
表8-2列出氢和氧在不同电极上,不同电流密度下的过电位。
表8-2 氢和氧的过电位
电极材料 |
过电位/V |
过电位/V |
过电位/V
H2 O2 |
涂铂黑的Pt |
0.0154 0.398 |
0.0300 0.521 |
0.0405 0.638 |
0.024 0.721 |
0.068 0.85 |
0.288 1.28 |
|
0.479 0.422 |
0.584 0.580 |
0.801 0.660 |
|
0.241 0.673 |
0.390 0.963 |
0.588 1.244 |
|
0.4751 0.580 |
0.7681 0.729 |
0.8749 0.984 |
|
0.563 0.353 |
0.747 0.519 |
1.048 0.726 |
|
0.90 |
1.0 |
1.1 |
|
0.716 |
0.746 |
1.064 |
