第八章 电化学分析法导论
 知识点二:化学电池
知识点二:化学电池
化学能与电能互相转变的装置称为电化学电池。电化学电池又分为产生电能的原电池和消耗外电能源的电解池。原电池将化学能转变为电能,电解池将电能转变为化学能。电化学电池是任何一类电化学分析法中必不可少的装置。
一、化学电池的构成
每个电化学电池都含有两个称为电极的导体,这两个电极必须插在适当的电解质溶液中,这是构成电化学电池的两个必要条件。两个电极可以是相同的或不同的电子导体,它们所接触的电解质可以是相同的或不同的离子导体。一支电极与它所接触的电解质溶液构成一个半电池。两个半电池组成一个电化学电池。为使两个半电池的电解质溶液互不混溶又能相互导电,需要用半透性隔膜或盐桥将它们隔离。
1)盐桥的构成:
盐桥是一个内置琼脂和高浓度盐溶液的U型玻璃管,,两端用多孔玻璃封堵,防止琼脂流出但离子可进出。
2)盐桥的作用:
① 将两半电池的电解质溶液分开,以防止干扰电极反应(例如铜离子直接 在锌电极上反应);
② 形成电流回路;
③ 消除液体接界电位。
二、原电池
如果将金属锌放入盛有CuSO4溶液的烧杯中,则发生如下反应:
![]() (8-1)
(8-1)
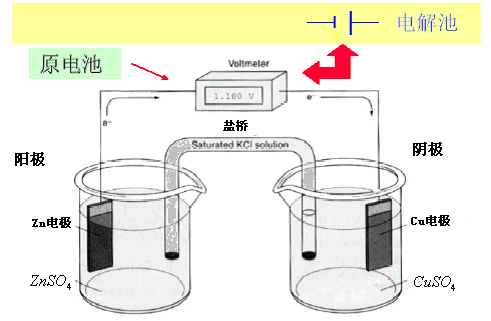
当反应直接在烧杯中进行时,会使溶液温度升高,因为化学能变成了电能。若把锌棒插入ZnSO4溶液中,铜棒插CuSO4,二者用盐桥隔开,使上述反应分开进行(如图8-1所示),就构成了铜锌电池,又称丹尼尔电池。
图8-1 铜锌原电池示意图
总电池反应为![]() (8-2)
(8-2)
由于Zn比Cu活泼,所以Zn原子较容易失去2个电子,氧化成Zn2+而进入溶液。Cu2+则接受2个电子,成为金属铜析出在铜电极上。在Zn电极上发生的是氧化反应,称为阳极;Cu电极是发生的是还原反应,称为阴极。
为了方便,可将图8-1的原电池表示为
Zn│ (c1)││ (c2)│Cu
按规定阳极和有关溶液在左边,阴极和有关溶液在右边。“”表示不同的相界面,每个界面都有电势差。“ ”表示盐桥,被隔开的硫酸盐溶液之间存在相界,也产生电势差,液体接界电位。盐桥的作用是消除或减小液体接界电位。
原电池两极间最大电位差称为原电池电动势:
E电池=E阴-E阳+E液界 (8-3)
使用盐桥时,E液界 视为零。(8.3)式简化为:
E电池=E阴-E阳 (8-4)
对于原电池,E电池>0, 表示反应自发进行。
二、电解池
当外加电源正极接到铜-锌原电池的铜电极上,负极接到锌电极上(图8-1),如果外加电压大于原电池的电动势,则两极十的电极反应与原电池的电极反应相反。此时锌电极发生还原反应常温阴极,铜电极发生氧化反应成为阳极。
对于电解池,E电池<0,反应需要消耗电能才能进行。在一定条件下,原电池和电解池可以相互转化。
