第六章 核磁共振波谱法
 知识点二:核磁共振波谱主要参数
知识点二:核磁共振波谱主要参数
核磁共振波谱主要用于结构分析中的主要参数有化学位移、自旋耦合常数、信号强度(峰面积)和驰豫时间。
一、化学位移及其影响因素
(一) 屏蔽常数和化学位移
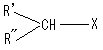
我们知道,大多数有机物都含有氢原子(1H核),从前述公式 可以看出,在B0一定的磁场中,若分子中的所有1H都是一样的性质,即γ H都相等,则共振频率ν0一致,这时只将出现一个吸收峰,这对NMR来说,将毫无意义。
事实上,质子的共振频率不仅与B0有关,而且与核的磁矩或 γ有关,而磁矩或γ与质子在化合物中所处的化学环境有关。
当1H核自旋时,核周围的电子云也随之转动,在外磁场作用下,会感应产生一个与外加磁场方向相反的次级磁场,实际上会使外磁场减弱,这种作用称为屏蔽效应,如图6-4所示。
1H核由于在化合物中所处的化学环境不同,核外电子云的密度也不同,屏蔽作用的大小亦不同,所以在同一B0下,不同1H核的共振吸收峰频率有差异。
图6-4 核外电子对核的屏蔽作用
用B0代表外磁场强度,σ为屏蔽常数,σB0为感应产生的次级磁场强度,B为氢核真正受到的有效外磁场强度,其关系用下式表示:
![]() (6-12)
(6-12)
将式(6-8)代入,得
![]() (6-13)
(6-13)
![]() (6-14)
(6-14)
或![]() (6-15)
(6-15)
![]() (6-16)
(6-16)
由式(6-15)和(6-16)可知,由于氢核具有不同屏蔽常数σ,引起外磁场或共振频率的移动,这种现象称为化学位移。NMR方法就是通过测量或比较质子的化学位移了解分子结构。
因化学位移的数值比起共振频率和外磁场强度是一个很小的数值,要精确测定其绝对值比较困难,并且在不同强度磁场中仪器测量的数据存在一定的差别,故采用相对化学位移来表示。在实际应用中用一种参考物质作标准,以试样与标准的共振频率(νx与νs)或磁场强度(Bx与Bs)的差值同所用仪器的频率ν0或磁场强度B0的比值δ来表示。δ表示相对位移,因其数值极小,需乘以106。
于待测物中加一标准物质(如TMS),分别测定待测物和标准物的吸收频率νx和νs,以下式来表示化学位移δ:
![]() (6-17)
(6-17)
![]() (6-18)
(6-18)
δ无量纲,对于给定的质子峰,其值与射频辐射无关。
在NMR中,通常以四甲基硅烷TMS作标准物,其优点是:1.由于四个甲基中12个H核所处的化学环境完全相同,因此在核磁共振图上只出现一个尖锐的吸收峰。2.屏蔽常数 较大,因而其吸收峰远离待研究的峰的高磁场(低频)区。规定TMS的化学位移为零,其它氢核的化学位移一般在TMS的一侧。3.具有化学惰性。4.溶于有机物、易被挥发除去。
(二)影响化学位移的因素
如前所述,凡是影响屏蔽常数σ(电子云密度)的因素均可影响化学位移,即影响NMR吸收峰的位置。
1.电负性 如果与氢核相连的原子或原子团电负性较强,使氢核周围电子云密度下降,产生去屏蔽效应,s下降,产生共振所需磁场强度小,化学位移值大。表6-2中列出了几种CH3X中氢核化学位移与元素电负性的关系。
表6-2 CH3X化学位移与元素电负性的关系
化学式 |
CH3F |
CH3Cl |
CH3Br |
CH3I |
CH4 |
(CH3)4Si |
电负性 |
4.0 |
3.1 |
2.8 |
2.5 |
2.1 |
0 |
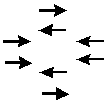
2.磁各向异性效应 在外磁场中的作用下,分子中处于某一化学键的不同空间位置的氢核,受到不同的屏蔽作用,这种现象称为化学键的磁各向异性效应。其原因是电子构成的化学键在外磁场作用下产生一个各向异性的次级磁场,使得某些位置上的氢核受到屏蔽效应,而另一些位置上的氢核受到去屏蔽区效应。例如,芳环的大键在外磁场作用下形成上下两圈电子环电流,因而苯环平面上下电子云密度大,形成屏蔽区(以+号表示),而环平面各侧电子云密度降低,形成去屏蔽区(以-号表示),如图6-5所示。
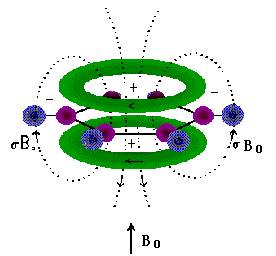
图6-5 苯环中电子的感应环流
苯环的氢核正处于去屏蔽区,共振信号向低场移动,其化学位移值大(δ = 7.25);如果分子中有的氢核处于苯环的屏蔽区,则共振信号向高场移动,其值会减小。双键电子的情况与苯环相似,如乙烯的氢核处于弱屏蔽区,其化学位移值较大(δ = 5.28);三键的各向异性使乙炔的氢核位于屏蔽区,其化学位移值较小(δ = 2.88)。
3.氢键和溶剂影响 键合在杂原子上的质子易形成氢键。氢键质子比没有形成氢键的质子有较小的屏蔽效应。形成氢键倾向愈强烈,质子受到的屏蔽效应就越小,因此,在较低场发生共振,即化学位移值较大。形成氢键倾向受溶剂浓度影响,如在极稀的甲醇溶液中,平衡向非氢键方向移动,故羟基中质子的化学位移范围在0.5~1.0;而在浓溶液中,化学位移值却为4.0~5.0。
氢键效应使电子云密度平均化,使OH或SH中质子移向低场。如分子间形成氢键,其化学位移与溶剂特性及其浓度有关;如分子内形成氢键则与溶剂浓度无关,只与分子本身结构有关。溶剂选择原则:稀溶液;不能与溶质有强烈相互作用。在核磁共振波谱分析中,一定要注明在什么溶剂条件下测得的化学位移值。
人们已将分子结构与化学位移的对应关系编制成一系列图表,表6-3是其中一部分。
表6-3 各种取代基上的甲基、亚甲基和次甲基核的化学位移
取代基X |
CH3—X |
R'CH2—X |
|
|
0.9 |
1.25 |
1.5 |
—C═C— |
1.7 |
1.95 |
2.6 |
—C≡C—R |
1.8 |
1.8 |
2.8 |
—COOR |
2.0 |
2.34 |
2.57 |
—CN |
2.0 |
2.48 |
2.7 |
—COOH |
2.07 |
2.34 |
2.57 |
—CONR2 |
2.02 |
2.05 |
2.4 |
—COR |
2.10 |
2.40 |
2.5 |
—SR |
2.10 |
2.40 |
3.1 |
—NH2或—NR2 |
2.15 |
2.50 |
2.87 |
—I |
2.16 |
3.15 |
4.2 |
|
2.34 |
2.62 |
2.87 |
—Br |
2.65 |
3.34 |
4.1 |
—NHCOR |
2.9 |
3.3 |
3.5 |
—Cl |
3.05 |
3.44 |
4.02 |
—OR |
3.3 |
3.36 |
3.8 |
—OH |
3.38 |
3.56 |
3.85 |
—OCOR |
3.65 |
4.15 |
5.01 |
|
3.73 |
3.90 |
4.0 |
|
3.9 |
4.23 |
5.12 |
—F |
4.26 |
4.35 |
4.8 |
—NO2 |
4.33 |
4.40 |
4.6 |
二、偶合常数J
(一)自旋偶合与自旋裂分
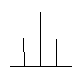
化学位移是磁性核所处化学环境的表征,但是在核磁共振谱中化学位移等同的核,其共振峰并不总表现为一个单一峰。图6-6为氯乙烷的核磁共振谱图,可以看到,δ = 1.03~1.35处的—CH3峰有一个三重精细结构;在δ = 3.08~3.44处的-CH2峰有一个四重精细结构。氢核吸收峰的裂分是因为分子中相邻氢核之间发生了自旋相互作用,自旋核与自旋核的相互作用称为自旋-自旋偶合。这种作用虽然不影响化学位移,但会使共振峰形发生变化,引起峰的裂分,使谱线增多,简称自旋裂分。
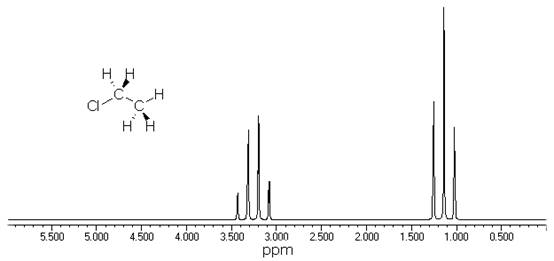
图6-6 CH3CH2Cl的NMR谱
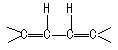
CH3CH2Cl分子中存在两组氢核。一组是组成-CH3基团的同磁性Ha,另一组是组成-CH2基团的同磁性Hb。在磁核共振分析时,Ha核除受磁场B0的作用外,还受相邻碳原子(-CH2)上的2个Hb核自旋(4种自旋取向方式)的影响,使Ha核受到的场强发生变化;同理,Hb核除受到B0的作用外,还受到相邻碳原子(-CH3)中3个Ha核自旋(8种自旋取向方式)的影响,也使Hb核受到的场强发生变化。这种自旋偶合作用,不仅产生谱线的裂分,而且裂分的谱线强度比也一定。
表6-4展示了CH3CH2Cl自旋偶合谱线多重分裂的基本原理。
表6-4 CH3CH2Cl分子中-CH3和-CH2氢核的裂分
-CH3中的氢核 |
Ha |
Hb |
-CH2 中的氢核 |
2个Hb的 |
|
|
3个Ha的 |
外磁场方向 |
|
|
外磁场方向 |
Hb使Ha共振峰 |
|
|
Ha使Hb共振峰 |
各峰面积比 |
1:2:1 |
1:3:3:1 |
各峰面积比 |
自旋偶合和裂分一般具有如下规律:
1.裂分峰数目由相邻偶合氢核数目n决定,即遵循n+1重峰规律。裂分峰之间的峰面积(或强度)之比符合二项式(a + b)n各项系数比的规律。一个(组)磁等价质子与相邻碳上的n个磁等价质子偶合,将产生n+1重峰。例如,二重峰表示相邻碳原子上有一个质子;三重峰表示有二个质子;四重峰则表示有三个质子。而裂分后各组多重峰的强度比为:二重峰1:1;三重峰1:2:1;四重峰1:3:3:1。
一个(组)质子与相邻碳上的两组质子(分别为n个和n’个质子)偶合,如果该两组碳上的质子性质类似的,则将产生n+n’+1重峰,如CH3CH2CH3;如果性质不类似,则将产生(n+1)(n’+1)重峰,如CH3CH2CH2NO2。
2.一组多重峰的中点,就是该质子的化学位移值。
3.分子中化学位移相同的氢核称为化学等价核,化学等价质子具有相同的化学环境。化学位移相同,核磁性也相同的核称为磁等价核。磁等价核之间虽有偶合作用,但无裂分现象。如ClCH2CH2Cl中的氢核皆是磁等价核,只有单重峰。只有磁不等价的氢核之间才能发生自旋偶合。
如下情况的氢核是磁不等价氢核:
(1) 化学环境不同的氢核;
(2) 与不对称碳原子相连的-CH2上的氢核;
(3) 固定在环上的-CH2中氢核;
(4) 单键带有双键性质时会产生磁不等价氢核;
(5)单键不能自由旋转时也会产生磁不等价氢核。
(二)偶合常数J
由自旋偶合作用产生的多重峰,裂分峰的间距称为偶合常数,以J表示,单位为Hz。J值大小表示氢核之间相互偶合作用的强弱。偶合常数具有以下规律:
1.偶合常数J或自旋分裂程度的大小与场强无关。影响值大小的主要因素是原子核的磁性和分子结构及构象。因此可以通过改变B0,看δ是否变化来判断是何种位移。
2.简单自旋偶合体系J值等于多重峰的间距,复杂自旋偶合体系J值需要复杂的计算求得。常数与分子结构的关系:
(1)同碳质子J:相隔两个化学键,J最大,但由于各质子性质完全一致,所以只观察到一个单峰。
(2)邻碳质子:相隔三个化学键,J较大,是立体分子结构分析最为重要的偶合分裂。图6-7是邻碳质子的Karplus曲线。从中可见,不同位置上的核,相互之间的偶合常数不同,其大小与它们各自所在的平面的夹角有关。
图6-7 邻碳质子的Karplus曲线
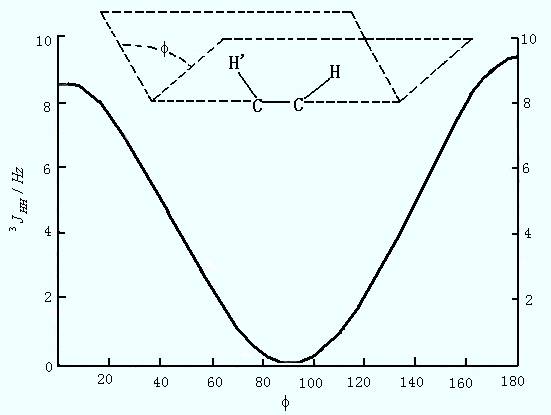
(3)远程偶合:核之间的作用较小,很少观察到分裂。
耦合常数的大小与外磁场强度无关,主要与原子核对磁性和分子结构将构象有关。可根据J值的大小及其变化规律,推断分子的结构和构象。目前已经积累了大量耦合常数与结构关系的实验数据,供结构分析时参考。表6-5列出了一些典型的氢核的自旋耦合常数。
表6-5 典型的氢核自旋偶合常数(绝对值)
类 型 |
JHH/HZ |
类 型 |
JHH/HZ |
|
12~15 |
|
10 |
|
6~8 |
|
J1-2=6~10 |
|
0 |
|
J2-3=4.9~5.7 |
|
顺式7~11 |
|
J2-3=1.6~2.0 |
|
3~6 |
||
|
2~3 |
|
J2-3=4.9~6.2 |
|
2~3 |