第四章 紫外—可见吸收光谱法
 知识点一:紫外可见吸收光谱
知识点一:紫外可见吸收光谱
紫外-可见吸收光谱(Ultraviolet-Visible Absorption Spectrometry)是利用某些物质的分子或离子对紫外和可见光谱区辐射能的吸收来研究物质的组成和结构的方法。这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级间的跃迁,广泛用于无机和有机物质的定性和定量测定。紫外-可见光谱区域的详细划分如图4-1所示。紫外-可见光区一般用波长(nm)表示。
紫外光是波长为10~400 nm的电磁辐射,分为远紫外光(10~200nm)和近紫外光(200~380 nm)。远紫外光可被大气中的水气、氮、氧和二氧化碳等所吸收,只能在真空中研究,故又称真空紫外光。本章仅讨论近紫外光谱。
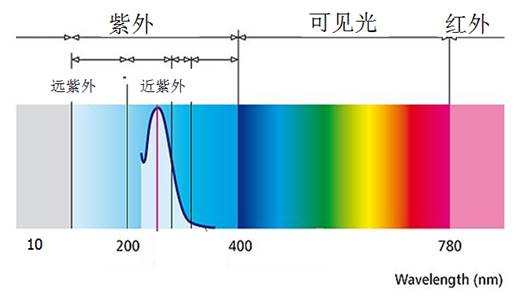
图4-1 紫外可见光谱区域
可见光是指波长为380~780nm的电磁辐射,它可被人的眼睛所感觉。溶液中物质选择性地吸收可见光中某种颜色的光,溶液就会呈现出一定的颜色。表
4-1列出了物质的颜色与吸收光颜色之间的互补关系。
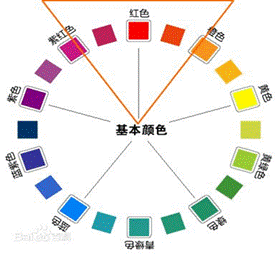
表4-1 物质颜色与吸收光颜色的关系
不同物质具有不同的分子结构,对不同波长的光会产生选择性吸收,因而具有不同的吸收光谱。无机化合物和有机化合物吸收光谱的产生在本质上是相同的,都是外层电子跃迁的结果,但二者在电子跃迁类型上有一定的区别。
一、紫外可见光谱与分子结构的关系
(一) 紫外可见光谱的形成
分子中的电子总是处在某一运动状态中,每一种状态都具有一定的能量,属于一定能级。电子由于受到光、热、电等的激发,从一个能级转移到另一个能级,称为跃迁。由于分子内部运动所牵涉到的能级变化比较复杂,分子吸收光谱也就比较复杂。在分子内部除了电子运动状态外,还有核间的相对运动,即核的振动和分子围绕着重心的转动。而按量子力学计算,振动能和转动能是不连续的,具有量子化的性质。分子的总能量是其键能(电子能)、振动能和转动能的总和。当分子从辐射的电磁波吸收能量之后,电子会从低能级跃迁到较高的能级,它的能量变化ΔE为其振动能变化ΔEν、转动能变化ΔEr以及电子运动能量变化ΔEε的总和,即
![]() (4-1)
(4-1)
式(4-1)中ΔEε最大,一般在1~20eV之间。
吸收频率决定于分子的能级差,其计算式为:
![]() 或
或 ![]() (4-2)
(4-2)
式中ΔE为分于跃迁前后能级差,、λ分别为所吸收的电磁波的频率及波长, C为光速,h为普朗克常数。
现假设ΔEε为5eV,其相应波长为
![]()
因此,由于分子内部电子能级的跃迁而产生的光谱位于紫外区或可见区内。
分子振动能级间隔ΔEν大约比ΔEε小10倍,一般在0.05~1eV之间。如果ΔEν为0.1eV,即为5eV的电子能级间隔的2%,则在发生电子能级跃迁的同时,必然要发生振动能级之间的跃迁,得到的是一系列的谱线,它们相互波长的间隔是250nm×2% = 5nm,而不是250 nm单一的谱线。
分子转动能级间隔 大约比ΔEν小10倍或100倍,一般小于0.05eV。现假设ΔEr为0.005eV ,则为5eV是电子能级间隔的0.1%。当发生电子能级和振动能级之间的跃迁时,必然要发生转动能级之间的跃迁。由于得到的谱线彼此间的波长间隔只有250nm×0.1% = 0.25nm,如此小的间隔使它们连在一起,呈现带状,称为带状光谱。
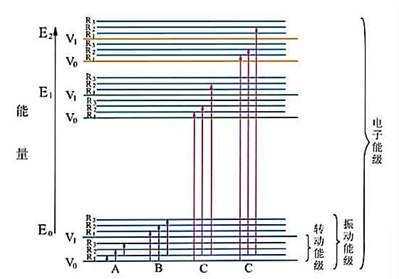
A:转动能级跃迁(远红外区) B:转动/振动能级跃迁(近红外区)
C:转动/振动/电子能级跃迁(可见,紫外区)
图4-2是电磁波与分子能级相互作用示意图
物质对不同波长的光具有不同的吸收能力,物质也只能选择性地吸收那些能量相当于该分子振动能变化ΔEν、转动能变化ΔEr以及电子运动能量变化ΔEε总和的辐射。由于各种分子内部结构不同,分子的能级也千差万别,各种能级之间的间隔也互不相同,这样就决定了它们对不同波长的光线的选择性吸收。如果改变通过某一吸收物质的入射光的波长,并记录该物质在每一波长处的吸光度(A),然后以波长为横坐标,以吸光度为纵坐标作图,这样的谱图称为该物质的吸收光谱或吸收曲线。某物质的吸收光谱反映了它在不同的光谱区域内吸收能力的分布情况,可以从波形,波峰的强度、位置及数目看出来,为研究物质的内部结构提供重要的信息。
(二)电子跃迁类型
有机化合物分子结构中,有成键的电子和电子,不成键的n电子(往往是p电子)。单键是由电子组成的,又称单键。双键是由和键组成。此外还有未成键的*反键和*反键轨道。各种分子轨道能量高低的顺序为:
σ﹤π﹤n﹤π*﹤σ*
分子吸收紫外或可见辐射后,经常遇到的跃迁有σ→σ*、n→σ*、n→π*、π→π*和四种类型,如图4-3所示。
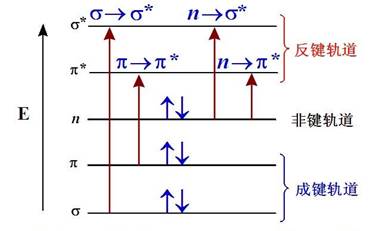
图 4-3电子能级和跃迁类型
1.σ→σ*和n→σ*跃迁
分子中形成单键的电子为电子,要使其由成键轨道跃迁到相应的σ*轨道上,所需能量很大,此能量相当于真空紫外区的辐射能。饱和烃只发生σ→σ*跃迁,因而吸收光谱都在真空紫外区。
含有未共用电子对(即n电子)原子的饱和化合物都可发生n→σ*跃迁,所需能量小于σ→σ*跃迁,一般相应于150-250 nm区域的辐射能。其中大多数吸收峰出现在低于200 nm的真空紫外区。
2. n→π*和π→π*跃迁
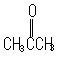
在含有不饱和键如>C=C<、-C≡C-、-N=N-、>C=O等有机化合物分子中含有电子,可以发生π→π*跃迁。若形成不饱和键的原子含有非键电子,则也能发生n→π*跃迁。这两类跃迁所产生的吸收峰波长一般都大于200 nm。有机化合物的紫外可见光谱法的分析就是以这两类跃迁为基础的。这两类跃迁都要求化合物中含有不饱和官能团以提供轨道。将含有键的不饱和基团称为生色团。
表4-2 一些常见生色团的吸收特性
生色团 |
化合物举例 |
溶剂 |
λmax/nm |
εmax/L·mol-1·cm-1 |
电子跃迁类型 |
烯键 |
C6H13C═CH2 |
正庚烷 |
177 |
13000 |
π→π* |
炔键 |
C5H11≡CCH3 |
正庚烷 |
178 |
10000 |
π→π* |
羰基 |
|
异辛烷
异辛烷 |
279
290 |
13
17 |
n→π*
n→π* |
羧基 |
CH3COOH |
乙醇 |
204 |
41 |
n→π* |
酰胺 |
CH3CONH2 |
水 |
214 |
60 |
n→π* |
偶氮基 |
CH3═NCH3 |
乙醇 |
339 |
5 |
n→π* |
硝基 |
CH3NO2 |
异辛烷 |
280 |
22 |
n→π* |
亚硝基 |
C4H9NO |
乙醚 |
300 |
100 |
n→π* |
硝酸酯 |
C2H5ONO2 |
二氧六环 |
270 |
12 |
n→π* |
n→π*跃迁比π→π*跃迁的能量小,吸收波长要更长一些。但由于轨道与*轨道的重叠很少,跃迁概率很小,摩尔吸收系数仅在10~100 L·mol-1·cm-1 范围内。π→π*跃迁的摩尔吸收系数则很大,具有单个非饱和键的化合物的摩尔吸收系数大约在104 L·mol-1·cm-1左右。
(三)生色团的共轭作用
如果一个化合物的的分子含有数个生色团,但它们并不发生共轭作用,那么该化合物的吸收光谱将包含有这些个别生色团的吸收带。
如果两个生色团彼相邻生成了共轭体系,那么原来各自生色团的吸收带就消失了,而产生新的吸收带。新吸收带的位置一般比原来的吸收带处在较长的波长处,而且吸收强度也显著增加。这一现象叫生色团的共轭效应。按照分子轨道理论,在共轭体系中,电子具有更大的离域性,这一离域效应使得*轨道能量下降,从而导致吸收峰红移。
对于多烯化合物,非共轭体系的最大吸收波长与含一个烯键的化合物基本相同,但摩尔吸收系数则与烯键数目同步增大。例如,1-己烯的最大吸收波长在177 nm,摩尔吸收系数为11800 L·mol-1·cm-1;1,5-己二烯的最大吸收波长在178 nm,摩尔吸收系数为26000 L·mol-1·cm-1。共轭多烯化合物随着共轭体系的增大其吸收峰红移,摩尔吸收系数也会随共轭体系增二发生显著变化。表4-3说明了这种关系。
表4-3 共轭作用对烯烃吸收的影响
|
化合物H(CH≡CH)nH |
溶 剂 |
λmax/nm |
εmax/L·mol-1·cm-1 |
n=1 |
己烯 |
蒸气 |
162 |
10000 |
n=2 |
1,3-丁二烯 |
蒸气 |
210 |
— |
n=3 |
1,3,5-己三烯 |
异辛烯 |
268 |
42700 |
n=4 |
1,3,5,7-辛四烯 |
环己烷 |
404 |
— |
n=5 |
1,3,5,7,9-癸五烯 |
异辛烷 |
434 |
121000 |
n=11 |
β-胡萝卜素 |
己烷 |
480 |
139000 |
芳香族化合物的 具有由π→π*跃迁产生的三个特征吸收谱带。例如,苯在184nm处有也强吸收带(εmax=60000L·mol-1·cm-1),在204nm处有一较强吸收带(εmax=7400L·mol-1·cm-1),在254nm处有一弱吸收带(B带,εmax=200L·mol-1·cm-1))。 B吸收带是由π→π*跃迁和苯环的振动能级跃迁叠加而产生,具有很好的振动精细结构,经常用于芳香族化合物的辨认。苯的这三个吸收带受苯环上取代基的强烈影响。当苯环上有-OH、-NH2等取代基时吸收峰红移,吸收强度增大。
与红移效应相反,有时在某些生色团(如C=O) 的碳原子一端引入一些取代基之后(-CH2、-CH2CH3),吸收峰的最大吸收波长向短波方向移动,这种效应称为蓝移效应。
助色团是一种能使生色团吸收峰向长波位移并增强其强度的官能团。如-OH、-NH2、-SH及一些卤族元素等。这些基团中都含有孤电子对,它们能与生色团中电子相互作用,使 *跃迁能量降低并跃迁吸收峰位移。
化学家们根据大量有机化合物紫外吸收光谱的综合分析,逐渐得出分子结构与紫外光谱之间规律性的关系。
根据这些关系,可以由分子结构来推测吸收峰的位置。也可以知道化合物骨架和紫外吸收最大吸收波长的关系,并进一步推测分子结构。紫外吸收光谱也用于有机物的定量分析。
表4-4 某些苯衍生物的吸收特性
化合物 |
分子式 |
溶剂 |
λmax/nm |
emax/L•mol-1•cm-1 |
苯 |
C6H6 |
2﹪甲醇 |
254 |
200 |
204 |
7400 |
|||
甲苯 |
C6H5CH3 |
2﹪甲醇 |
262 |
225 |
208 |
7000 |
|||
氯苯 |
C6H5Cl |
2﹪甲醇 |
264 |
190 |
210 |
7400 |
|||
碘苯 |
C6H5I |
2﹪甲醇 |
258 |
700 |
207 |
7000 |
|||
苯酚 |
C6H5OH |
2﹪甲醇 |
271 |
1260 |
213 |
6200 |
|||
酚盐离子 |
C6H5O- |
2﹪甲醇 |
286 |
2400 |
235 |
9400 |
|||
苯甲酸 |
C6H5COOH |
2﹪甲醇 |
272 |
970 |
230 |
11600 |
|||
苯胺 |
C6H5NH2 |
2﹪甲醇 |
280 |
1320 |
230 |
8600 |
|||
苯胺盐离子 |
C6H5NH3+ |
2﹪甲醇 |
254 |
169 |
203 |
7500 |
(四)溶剂对吸收光谱的影响
溶剂的极性不同也会引起某些化合物吸收光谱的红移或蓝移,这种作用称为溶剂效应。在π→π*跃迁中,激发态极性大于基态,当使用极性大的溶剂时,由于溶剂与溶质相互作用,激发态π*比基态π的能量下降更多,因而激发态与基态之间的能量差减小,导致吸收谱带λmax红移。而在n→π*跃迁中,基态n电子与极性溶剂形成氢键,降低了基态能量,使激发态与基态之间的能量差变大,导致了吸收带λmax向短波方向移动(蓝移)。
二、光谱吸收曲线
(一)朗伯-比尔(Lambert-Beer)定律
朗伯-比尔定律是光吸收的基本定律,也是分光光度分析法的依据和基础。当入射波长一定时,溶液的吸光度A是待测物质浓度和液层厚度的函数。
朗伯-比尔定律的数学表达式为:
![]() (4-3)
(4-3)
为摩尔吸光系数,单位L·mol-1·cm-1 。其物理意义是吸光物质的浓度为1 mol·L-1,液层厚度为1cm时溶液的吸光度。b是液层厚度,单位为cm ,c是物质的浓度,单位为mol·L-1 。
(二)光谱曲线的表示方法
将不同波长的单色光依次通过被分析物质,分别测得不同波长下的吸光度或透光率,然后绘制吸收强度参数-波长曲线,即为物质的吸收光谱(图4-4)。在紫外-可见光谱中,横波长用nm为单位,纵坐标为吸光度,具有最大吸收值的波长称为最大吸收波长λmax。物质的吸收曲线包含如下信息:
1.同一种物质对不同波长光的吸光度不同。吸光度最大处对应的波长称为最大吸收波长 λmax。
2.浓度不影响吸收曲线形状和λmax。
3.不同物质,它们的吸收曲线形状和λmax则不同。所以吸收曲线可以提供物质的结构信息,并作为物质定性分析的依据之一。
4.不同浓度的同一种物质,在λmax处吸光度A的差异最大,测定最灵敏。
5.吸光度具有加和性,A = A1 + A2 + A3 + …….。
在最大吸收波长处测得的摩尔吸光度系数εmax可以作为定性的依据。因为有时不同物质的λmax可能相同,但它们的εmax不一定相同。
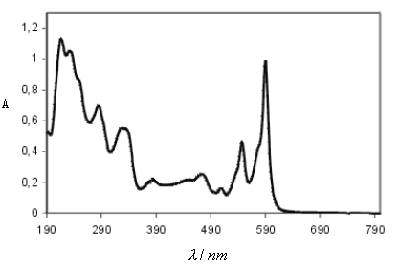
图4-4 紫外可见吸收光谱